
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
частина
3.1
2Cu + О2 = 2СuО;
CuO + 2HNO3 = Cu(NO3)2 + Н2О;
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3;
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O.
3.2
 Дано: Розв'язання
Дано: Розв'язання
 m(AlCl3) = 3,204 г; 1 Знаходимо кількість речовини алюміній хлориду: m(AgNO3) = 10,2 г. v(AlCl3) = m(AlCl3) : М(АlСl3) = 3,204 г : 133,5 г/моль = m(AgCl) – ? 0,024 моль.
m(AlCl3) = 3,204 г; 1 Знаходимо кількість речовини алюміній хлориду: m(AgNO3) = 10,2 г. v(AlCl3) = m(AlCl3) : М(АlСl3) = 3,204 г : 133,5 г/моль = m(AgCl) – ? 0,024 моль.
2 Обчислюємо кількість речовини арґентум(І) нітрату:
v(AgNO3) = m(AgNO3): M(AgNO3) = 10,2 г : 170 г/моль = 0,06 моль.
3 Реакція між А1С13 і арґентум нітратом відбувається за рівнянням:
АlСl3 + 3AgNO3 = Al(NO3)3 + 3AgCl↓.
З рівняння реакції видно, що v1(AlCl3): v1(AgNO3) =1:3.
Таким чином, для взаємодії з 0,06 моль AgNO3 потрібно 0,02 моль АlСl3, а для реакції взяли 0,024 моль. Отже, АlСl3 взято в надлишку, тому масу осаду AgCl визначаємо за AgNO3.
4 Як бачимо з рівняння реакції v(AgCl) = v(AgNO3) = 0,06 моль.
Знаходимо масу осаду:
m(AgCl) = v(AgCl) • M(AgCl) = 0,06 моль • 143,5 г/моль = 8,61 г.
Відповідь: m(AgCl) = 8,61 г.
3.3
 Дано: Розв'язання
Дано: Розв'язання
V (NH3) = 89,6 л; 1. Знаходимо об'єм амоніаку, який виділяється під
∆1Н = –1528 кДж; час розкладу амоній карбонату:
m((NH4)2CO3) = 48 г. 8 г x
 ∆2H – ? (NH4)2CO3 = 2NH3 +H2O+ CO2.
∆2H – ? (NH4)2CO3 = 2NH3 +H2O+ CO2.
96 г 2 × 22,4 л
Унаслідок розкладу 96 г амоній карбонату утворюється 44,8 л амоніаку, а під час розкладу 48 г амоній карбонату — х л амоніаку. Отже,
48 : 96= x : 44,8.
Звідки x = 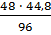 = 22,4 (л).
= 22,4 (л).
2. Обчислюємо кількість теплоти, яка виділиться під час згоряння 22,4 л амоніаку:
4NH3 + 5O2 = 4NO + 6Н2O; ∆1H = –1528 кДж.
Під час згоряння 89,6 л амоніаку виділяється 1528 кДж теплоти, а під час згоряння 22,4 л амоніаку —у кДж теплоти.
Отже, 89,6 : 22,4= 1528 : у.
Звідки у =  = 382 кДж.
= 382 кДж.
Відповідь: ∆2H = –382 кДж.
Дата добавления: 2015-04-21; просмотров: 225; Мы поможем в написании вашей работы!; Нарушение авторских прав |