
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приведіть методику та визначте біхроматну окисляємість (ХПК) очищеної стічної води на вході в аеротенк.
Залежно від ступеня забруднення досліджуваної води для аналізу беруть різні об’єми проби: так, якщо природна окисляємість знаходиться в межах 500-4000 мг кисню на 1л, для аналізу беруть 1 мл проби; якщо окислення вище ніж 4000 мг кисню на 1 л, пробу розбавляють; якщо окислення знаходиться в межах 50-500 мг кисню на 1 л, об’єм повинен бути рівним 5 мл.
Пробу відміряну піпеткою вміщають у конічну колбу ємністю 200-250 мл, додають 2,5 мл розчину біхромату калію з концентрацією 0,25 моль/л (1/3 К2Cr2O7), 0,2 г сульфату ртуті (2-х валентного) або сульфату срібла (1) і при обережному перемішуванні 7,5 мл на 1 мл проби або 15 мл на 5 мл проби концентрованої сірчаної кислоти. Розчин у колбі при цьому досягає температури вище ніж 100ºС. у цих умовах швидко проходить процес окислення всіх речовин біхроматом калію.
Через 2-3 хв колбу охолоджують до кімнатної температури, приливають 100 мл дистильованої води, 4 краплі 1%-го розчину дифеніламіну, 5 мл концентрованої 85%-ї фосфатної кислоти та надлишок біхромату калію відтитровують розчином солі Мора Fe(NH4)2(SO4)2*6H2O = 0.25 моль/л до зникнення синього забарвлення розчину.
В окремій пробі проводять холостий дослід титруванням 20 мл дистильованої води, до якої додають тіж реагенти і в тій же кількості, що й у досліджуваній пробі.
Розрахунок біхроматного окислення розраховують за формулою, мг/л:
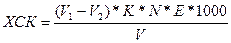 ,
,
де V1 – об’єм солі Мора, який пішов на титрування холостої проби, мл;
V2 – об’єм солі Мора, який пішов на титрування проби, мл;
К – поплавковий коефіцієнт, для приведення концентрації солі Мора;
V – об’єм проби, взятої для визначення;
Е – еквівалентна маса кисню, г/моль, (8 г/моль).

Дата добавления: 2015-04-21; просмотров: 188; Мы поможем в написании вашей работы!; Нарушение авторских прав |