
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет № 6. 1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие
1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток.
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной — между двумя атомами с одинаковой электроотрицательностью, т.е. в простых веществах, и полярной — между атомами, электроотрицательность которых различается, т.е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
H• + •H → H : H
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H–H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентроваясвязь, когда два электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10–11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. ..
H· + ·Cl: → H :Cl:
·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде — частичный положительный:
Hδ+–Clδ−
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) — акцептором электронной пары:
H+ + :NH3 → NH4+
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой:
H
l
[H — N → H ]+
l
H
Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
..
Na+ [:Cl:] −
··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток:
1. Ионная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).
2. Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
3. Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями, поэтому такие вещества непрочные, легкоплавкие (лёд, сера), зачастую возгоняются, т.е. при нагревании испаряются, минуя жидкую фазу, как сухой лёд CO2, йод I2
4. Металлическая кристаллическая решетка характерна для металлов, например, Fe
2. Опыт. Получение и собирание аммиака.
Для получения и собирания аммиака в лаборатории насыпаем в пробирку хлорид или сульфат аммония, смешанный с известью Ca(OH)2, затыкаем пробкой с газоотводной трубкой. Трубку вставляем в колбу, перевернутую вверх дном, — аммиак легче воздуха. Отверстие колбы закрываем куском ваты.
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную раствором фенолфталеина (ф-ф). Бумажка розовеет вследствие образования гидроксид-ионов:
NH3 + HOH 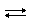 NH4+ + OH−
NH4+ + OH−
Дата добавления: 2015-04-21; просмотров: 292; Мы поможем в написании вашей работы!; Нарушение авторских прав |