
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Билет № 16. 1. Сера: положение этого химического элемента в периодической системе, строение его атома
1. Сера: положение этого химического элемента в периодической системе, строение его атома. Физические и химические свойства серы. Оксиды серы, их химические свойства.
Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе.
Атомный номер серы 16, следовательно, заряд атома серы равен + 16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов (равно номеру группы для главных подгрупп).
Схема расположения электронов по уровням:
16S ) ) )
2 8 6
Ядро атома серы 32S содержит 16 протонов (равно заряду ядра) и 16 нейтронов (атомная масса минус число протонов: 32 − 16 = 16).
Сера как простое вещество образует две аллотропные модификации: кристаллическая сера и пластическая.
Кристаллическая сера — твердое вещество желтого цвета, хрупкое, легкоплавкое (температура плавления 112° С), нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой. Поэтому порошок серы может плавать на поверхности, хотя сера тяжелее воды(плотность 2 г/см3).
На этом основан метод обогащения руд под названием флотация: измельченная руда погружается в емкость с водой, через которую продувается воздух. Частички полезной руды подхватываются пузырьками воздуха и выносятся наверх, а пустая порода (например, песок) оседает на дно.
Пластическая сера темного цвета и способна растягиваться, как резина.
Это отличие в свойствах связано со строением молекул: кристаллическая сера состоит из кольцевых молекул, содержащих 8 атомов серы, а в пластической сере атомы соединены в длинные цепи. Пластическую серу можно получить, если нагреть серу до кипения и вылить в холодную воду.
В уравнениях для простоты записывают серу без указания числа атомов в молекуле: S.
Химические свойства:
1. В реакциях с восстановителями: металлами, водородом, — сера проявляет себя как окислитель (степень окисления −2, валентность II). При нагревании порошков серы и железа образуется сульфид железа:
Fe + S = FeS
Со ртутью, натрием порошок серы реагирует при комнатной температуре:
Hg + S = HgS
2. При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S
3. В реакциях с сильными окислителями сера окисляется. Так, сера горит, образуется оксид серы (IV) — серни́стый газ:
S + O2 = SO2
Оксид серы (IV) — кислотный оксид. Реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Эта реакция происходит в атмосфере при сжигании каменного угля, который обычно содержит примеси серы. В результате выпадают кислотные дожди, поэтому очень важно подвергать очистке дымовые газы котельных.
В присутствии катализаторов оксид серы (IV) окисляется до оксида серы (VI):
2SO2 + O2 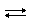 2SO3 (реакция обратима)
2SO3 (реакция обратима)
Оксид серы (VI) реагирует с водой с образованием серной кислоты:
SO3 + H2O = H2SO4
SO3 — бесцветная жидкость, кристаллизуется при 17° С, переходит в газообразное состояние при 45° С
2. Опыт. Проведение реакций, подтверждающих свойства гидроксида кальция.
1. Гидроксид кальция (гашеная известь) – малорастворимое вещество. Взбалтываем немного извести в 2 мл воды (около 2 см по высоте пробирки), даем постоять несколько минут. Большая часть извести не растворится, осядет на дно.
2. Сливаем раствор, фильтруем (если нет фильтра, ждем пока отстоится). Прозрачный раствор гидроксида кальция называетсяизвестковой водой. Делим на 2 пробирки. В одну капаем индикатор фенолфталеин (ф-ф), он окрашивается в малиновый цвет, что доказывает осно́вные свойства извести:
Ca(OH)2 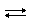 Ca2+ + 2OH−
Ca2+ + 2OH−
3. Во вторую пробирку пропускаем углекислый газ, известковая вода мутнеет в результате образования нерастворимого карбоната кальция (это качественная реакция для обнаружения углекислого газа):
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Если придется делать эти реакции на практике, углекислый газ можно получить в пробирке с газоотводной трубкой, добавив соляную или азотную кислоту в мел или соду.
Можно несколько раз пропустить выдыхаемый воздух через трубочку от коктейля или сока, принесенную с собой. Не стоит шокировать комиссию — дуть в трубку из лабораторного оборудования — в кабинете химии ничего нельзя пробовать на вкус! 
Дата добавления: 2015-04-21; просмотров: 295; Мы поможем в написании вашей работы!; Нарушение авторских прав |