
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ацетилен – представитель углеводородов с тройной связью в молекуле. Свойства, получение и применение ацетилена.
Алкинами называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый представитель этого класса — ацетилен НС ≡ СН, в связи с чем алкины также называют ацетиленовыми углеводородами. Ближайшие гомологи ацетилена:
| СН3-С ≡СН | СН3-СН2-C≡СН | СН3-С ≡ ССН3 |
| пропин | бутин-1 | бутин-2 |
Простейший алкин с разветвленным углеродным скелетом:
З-метилбутин-1
Общая формула гомологического ряда алкинов СnН2n-2.
Структурная изомерия алкинов обусловлена изомерией углеродного скелета (например, 3-метилбутин-1 и пентин-1) и изомерией положения тройной связи (бутин-1 и бутин-2).
Номенклатура. В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана окончание -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя. Номер после названия главной цепи указывает положение тройной связи, например:
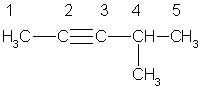
4-метилпентин-2
Физические свойства алкинов похожи на свойства алканов и алкенов.
Растворимость низших алкинов в воде несколько выше, чем алкенов и алканов, однако она все же очень мала.
Получение. 1. Общий способ получения алкинов — отщепление двух молекул галогеноводорода от дигалогеналканов, которые содержат два атома галогена либо у соседних, либо у одного атома углерода, под действием спиртового раствора щелочи.
| С2Н5ОН | ||
| СН2Вr - СН2Вr + 2КОН | → | НС ≡ СН + 2КВr + 2Н2О, |
| С2Н5ОН | |||
| СН3 - СВr2 - СН3 + 2КОН | → | СН3-С ≡ СН + 2КВr + 2Н2О, |
2. Ацетилен получают в промышленности путем высокотемпературного крекинга метана:
| 1500°С | ||
| 2СН4 | → | CH ≡ CH + ЗН2 |
или его ближайших гомологов — этана и пропана, причем в этом случае ацетилен образуется при более низких температурах:
| 1200°С | |||||
| 2С3Н8 | → | ЗС2Н2 + 5Н2 |
Сырьем в этих способах служит природный газ или нефть.
В лабораторных условиях ацетилен получают гидролизом карбида кальция:
СаС2 + 2Н2О = Са(ОН)2 + С2Н2 ↑
Химические свойства алкинов обусловлены наличием в их молекулах тройной связи. Типичными реакциями для ацетилена и его гомологов являются реакции присоединения. Отличие алкинов от алкенов заключается в том, что реакции присоединения могут протекать в две стадии. На первой стадии идет присоединение к тройной связи с образованием двойной связи, а на второй стадии — присоединение к двойной связи. Реакции присоединения для алкинов протекают медленнее, чем для алкенов.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии. Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:
| Вr2 | Вr2 | |||
| СН ≡ СН | → | СНВr = СНВr | → | СНВr 2- СНВr2 |
Алкины, так же, как и алкены, обесцвечивают бромную виду.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера поливинилхлорида.
| АlСl3 | ||
| СН ≡ СН + HCI | → | СН2 = СНСl |
В случае избытка галогеноводорода происходит полное гидрогалогенирование, причем для несимметричных алкинов на каждой стадии присоединение идет по правилу Марковникова, например:
| Аl Вr3 | ||
| СН3 - С ≡ СН + 2НВr | → | СН3 - СВr2 - СН3 . |
3. Гидратация.
| Hg2+. H+ | ||||||
| CH | ≡ | СН + Н2О | → | [СН2 = СН - ОН] | ≡ | СН3 – СН = О |
На первой стадии реакции образуется непредельный спирт.
В результате реакции гидратации только ацетилен превращается в альдегид; гидратация гомологов ацетилена протекает по правилу Марковникова;, и образуется ацетон:
| Hg2+ | ||
| СН3 – СН ≡ СН + Н2О | → | [СН3 - С(ОН) = СН2] → СН3 – СО - СН3. |
Реакция гидратации алкинов была открыта М.Г. Кучеровым (1881 г.) и носит название реакции Кучерова.
4. Полимеризация.
При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:
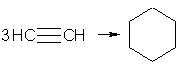 5. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
5. Реакции окисления и восстановления. Алкины легко окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:
R - C ≡ C-R' + 3[О] + Н2О → R - COOH + R' - COOH.
В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:
| Н2 | Н2 | |||
| СН3 — С ≡ СН | → | СН3 — СН — СН2 | → | СН3 — СН2 — СН3. |
Применение. На основе ацетилена развились многие отрасли промышленности органического синтеза: получения уксусного альдегида из ацетилена и различных кетонов из гомологов ацетилена по реакции Кучерова. Например, реакцией ацетилена с ацетоном можно получить изопрен — исходный продукт для получения синтетического каучука. Хлоропрен также получают из винилаиетилена. Ацетилен используется для сварки (кислородноацетиленовая сварка) металлов, поскольку при его горении развивается высокая температура.
Дата добавления: 2015-04-21; просмотров: 2337; Мы поможем в написании вашей работы!; Нарушение авторских прав |