
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона. В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
27. s,p,d,f-элементы, положение в периодической системе. Основные химические свойства.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства): 1) s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. 2) р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого). 3) d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами). 4) f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды. В периодической системе s-элементов 14, р-элементов 30, d-элементов 35, f-элементов 28. Элементы одного типа имеют ряд общих химических свойств.
В малых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 — в первом периоде, и от 1 до 8 — во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого периода) находится щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются свойства неметаллические.В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что объясняет и более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда число электронов на внешнем уровне остается постоянным и равно 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в этих рядах изменяются крайне медленно. Лишь в нечетных рядах, когда с ростом заряда ядра увеличивается число электронов на внешнем уровне (от 1 до 8), свойства элементов начинают изменяться так же, как у типических.
Свойства:
· энергия ионизации атомов;
· энергия сродства атомов к электрону;
· электроотрицательность;
· атомные (и ионные) радиусы;
· энергия атомизации простых веществ
· степени окисления;
· окислительные потенциалы простых веществ.
28. Природа химической связи. Метод валентных связей.
Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга (два или несколько атомов, ионов, молекул или любую комбинацию из них). Каждая химическая связь в структурных формулах представляется валентной чертой, например: H−H (связь между двумя атомами водорода), H3N−H+ (связь между атомом азота молекулы аммиака и катионом водорода),(K+)−(I−) (связь между катионом калия и иодид-ионом).
Химическая связь образуется за счет притяжения ядер атомов к паре электронов (обозначаются точками ··), которую в электронных формулах сложных частиц (молекул, сложных ионов) изображают валентной чертой −, в отличие от собственных, неподеленных пар электронов каждого атома, например:
:::F−F::: (F2); H−Cl::: (HCl);
..
H−N−H
|
H (NH3)
Атомы, образуя связи, приближаются к достижению наиболее устойчивой (т.е. имеющей наиболее низкую энергию) электронной конфигурации. Атомы могут достичь этого двумя способами:
Ковалентной химической связью (образуется путем обобществления пары электронов обоими атомами); Ионной связью (если атомы теряют либо приобретают электроны, образуя ионы); Металлическая связь (относится к металлам, в твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые «плавают» вокруг ионов в «электронном море»); Водородная связь (существенное участие принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом)
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения: 1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. 2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
29. Обменный и донорно-акцепторный механизмы образования ковалентной связи.
Обменный за счёт перекрывания одноэлектронных облаков с противоположными спинами; донорно-акцепторный за счет двухэлектронного облака одного атома и свободной орбитали другого. Обменный механизм - это когда каждый из взаимодействующих атомов поставляет по одному электрону, донорно-акцепторный механизм - это когда электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору). 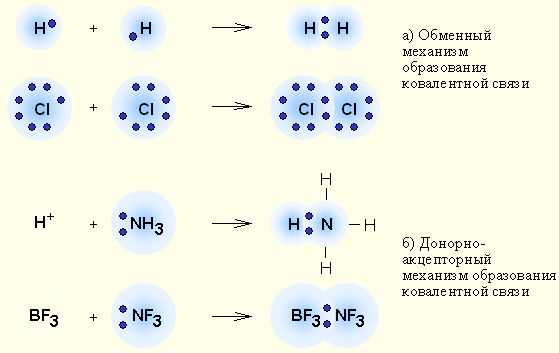
К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов.
По донорно-акцепторному механизму происходит образование иона аммония. Донор (азот) имеет электронную пару, акцептор – (Н+) свободную орбиталь, которую пара электронная азота может занять. В ионе аммония три связи азота с водородом образованы по обменному механизму, а одна по донорно-акцепторному. Все 4 связи равноценны.
30. Ковалентная связь. Её разновидности и свойства.
Ковалентная связь – химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений. Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными. Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей. Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, N2, Cl2. Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
Виды:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
1)Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, то такая связь называется неполярной ковалентной связью.
2) Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью.
2. Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера).
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
31.Валентность атомов в стационарном и возбуждённом состояниях. Кратность связи. сигма и пи связь.
Валентность характеризует способность атомов элементов к образованию соединений. Валентность определяется как число химических связей, которыми атом соединен с другими. Валентность атома химического элемента не может быть выше полного числа орбиталей на внешнем уровне этого элемента. У Атома в возбуженном состояии электроны перескакивают на другие свободные орбитали и он проявляет валентность равную числу неспаренных электронов.Например, в стационарном состоянии атом углерода проявляет валентность равную 2(имеет 2 неспаренных электрона), а в возбужденном равную 4.(имеет 4 неспаренных электрона).В стационарном состоянии 2s(2)2p(2) ---->2s(1)2p(3).
Химическая связь, осуществляемая более чем одной электронной парой, называется кратной связью. Кратность (порядок) связи — это число общих электронных пар, участвующих в образовании связи. Кратная связь может быть двойной, тройной, иметь более высокую кратность и даже дробную кратность. Кратная связь состоит из одной s-связи, p-связи и иногда d-связи. Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной симметрией распределения электронной плотности.
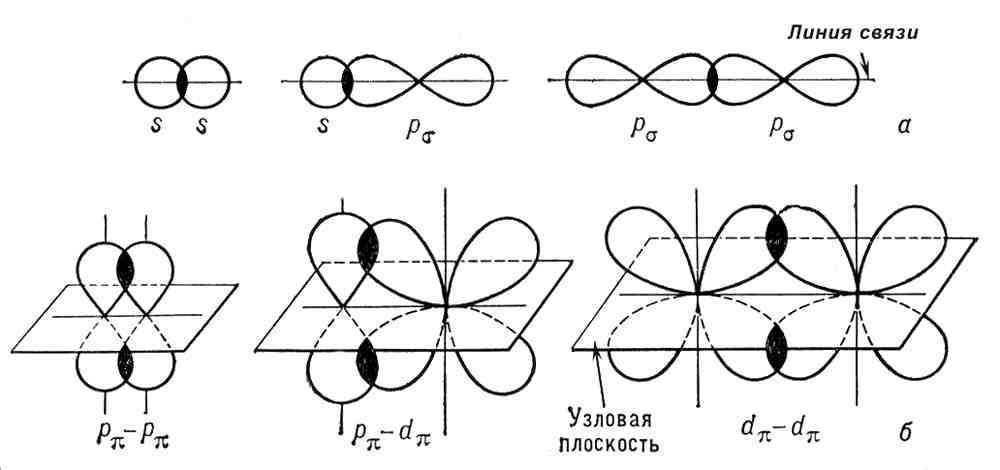
32.Гибридизация атомных орбиталей. Примеры. Пространственная конфигурация молекул с sp, sp², sp3- гибридизацией (примеры).
Гибридизация - это выравнивание атомных орбиталей по энергии с последующим их смешиванием. ΣАО = Σгибр.орб., например s + 3p + d = 5sp3d , s + 3d = 4sd3
Очень часто электроны, участвующие в образовании ковалентной связи, находятся в различных состояниях, например, один в s-, другой в p-орбиталях. Но связи в молекуле по прочности остаются равнозначны. Это объясняет представление о гибридизации атомных орбиталей, введенное в химию Л.Полингом. Гибридизацию валентных орбиталей рассмотрим на примере образования молекул хлорида бериллия BeCl2 хлорида бора BeCl3 и метана CH4.
В молекуле BeCl2 есть две связи Be—Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
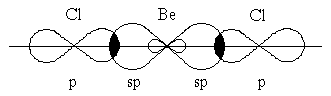
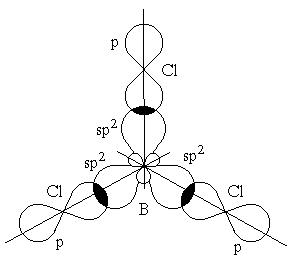
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о. Другой пример: в молекуле BCl3 имеется 3 связи B—F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120о :
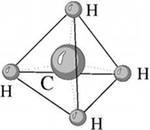
 Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся максимально далеко друг от друга только тогда, когда молекула примет форму тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H. Кстати, в "квадратной" молекуле расстояние между атомами водорода было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
В молекуле CH4 угол НСН такой же, как в математическом тетраэдре: 109о28’.
 33
33
Геометрическая фигура, состоящая из 1 вершины - точка (.) если 2(.) - отрезок, 3(.) - плоский треугольник, 4 (.) - либо плоский квадрат и его производные, либо тетраэдр или тригональная пирамида (искаженный тетраэдр).
33.Ионная связь. Ненаправленность и ненасыщаемость ионной связи. Свойства веществ с ионным типом связи.
Ионная или электровалентная связь - это химическая связь между ионами, осуществляемая электростатистическим притяжением. способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Ненаправленность характеризуется тем, что каждый ион, представляющий из себя заряженный шарик, может притягивать ион, противоположного знака по любому направлению. Ненасыщаемость определяется тем, что взаимодействие ионов противоположного знака не приводит к компенсации силовых полей и у них остаётся способность притягивать ионы противоположного знака по другим направлениям.
Ионные соединения образуются при взаимодействии элементов, значительно различающихся по химическим свойствам. Чем больше удалены друг от друга элементы в периодической системе, тем в большей степени проявляется в их соединениях ионная связь.
34.Виды межмолекулярного взаимодействия.
Межмолекулярные взаимодействия (м.в.) - взаимодействия молекул между собой, не приводящее к разрыву или образованию новых хим. связей. М. в. определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От М. в. зависят мн. структурные, спектральные, термодинамич., теплофиз. и др. св-ва в-в. Появление понятия М. в. связано с именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее М.в. (см. Ван-дер-Ваальса уравнение). Поэтому силы М.в. часто называют ван-дер-ваальсовыми. Различают три типа м.в.: ориентационное, индукционное, дисперсионное. При ориентационном взаимодействии происходит сближение полярных молекул, они ориентируются относительно друг друга противоположно заряженными концами диполей. чем более полярны молекулы, тем прочнее связь. с повышением температуры ориентационное взаимодействие ослабляется, т.к. тепловое движение нарушает ориентацию. Индукционное взаимодействие между полярной и неполярной молекулами: первая деформирует эл.облако второй. В результате у неполярной молекулы возникает временный электрический момент диполя, затем обе молекулы взаимодействуют как диполи. Индукционное взаимодействие не зависит от температуры, оно зависит от напряженности электрического поля полярной молекулы. Дисперсионное взаимодействие между двумя неполярными молекулами. В атомах и молекулах электроны сложным образом движутся вокруг ядер. В среднем по времени дипольные моменты неполярных молекул оказываются равными нулю. Но в каждый момент электроны занимают какое-то положение. Поэтому мгновенное значение дипольного момента (например, у атома водорода) отлично от нуля. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы. В результате возникает взаимодействие мгновенных диполей. Энергия взаимодействия между неполярными молекулами есть средний результат взаимодействия всевозможных мгновенных диполей с дипольными моментами, которые они наводят в соседних молекулах благодаря индукции. На дисперсионном взаимодействии основан процесс сжижения благородных двухатомных элементарных газов.
1).Энергия электростатического взаимодействия Vэл-ст представляет собой энергию кулоновского взаимодействие, вычисленную в предположении, что распределение зарядовой плотности отвечает изолированным молекулам (R =  )
)
2).Поляризационное взаимодействие обусловлено деформацией электронной оболочки одной молекулы под влиянием электрический поля другой, что всегда приводит к понижению энергии (притяжению молекул).
3). Энергия обменного взаимодействия молекул Vобм обусловлена тем, что в соответствии с принципом Паули в одном и том же квантовом состоянии не могут находиться два электрона с одинаковыми спинами. Вследствие этого электронная плотность в пространстве между молекулами при перекрывании их электронных оболочек уменьшается.
35.Водородная связь, её биологическая роль.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
Такая связь возникает между молекулами, в состав которых входят атомы водорода и элементов с высокойэлектроотрицательностью(F,Cl,O2,N)
Внутримолекулярные водородные связи играют важнейшую биологическую роль, так как определяют, например, спиральную структуру полимерных молекул белков.
С помощью межмолекулярных водородных связей соединены цепи нуклеиновых кислот, образующих двойную спираль. Посредством этой связи взаимодействуют спирали ДНК и РНК, белки, формируются мембраны биологических клеток.
36. Комплексные соединения. Теория Вернера. Роль в живом организме.
Комплексные соединения, координационные соединения, химические соединения, состав которых не укладывается в рамки представлений об образовании химических связей за счет неспаренных электронов. Обычно более сложные К. с. образуются при взаимодействии простых химических соединений.
Теория: Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+) либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
37. Диссоциация комплексных соединений. Константа нестойкости комплексных ионов.
При растворении в воде комплексных соединений, обычно они распадаются на ионы внешней и внутренней сфер подобно cильным электролитам, так как эти ионы связаны ионогенно, в основном, электростатическими силами. Это оценивается как первичная диссоциация комплексных соединений.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы на составляющие ее компоненты. Этот процесс протекает по типу слабых электролитов, так как частицы внутренней сферы связаны неионогенно (ковалентной связью).
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости
38. Химическая связь в комплексных соединениях (примеры).
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи преимущественно ионный.
Рассмотрим строение комплекса [Ag(NH3)2]+. Электронная конфигурация иона серебра
Свободные орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака.
5s- и 5p- орбитали иона Ag+ образуют две гибридные sp- орбитали, т.е. находятся с состоянии sp L q - гибридизации.
Комплекс имеет линейное строение.
Таким образом, электронное строение и тип гибридизации АО комплексообразователя определяют к.ч. и геометрическую форму комплекса.
39. Окислительно- восстановительные реакции. Виды окислительно- восстановительных реакций.
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Виды: 1) Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
2) Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
3) Репропорционирование (конпропорционирование
) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:NH4NO3 → N2O + 2H2O
40. Важнейшие окислители и восстановители. Окислительно- восстановительная двойственность.
| Восстановители | Окислители |
| Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. | Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
Окислительно-восстановительная двойственность – это способность атома, находящегося в промежуточной степени окисления, быть как восстановителем, так и окислителем, в зависимости от того, с каким веществом он реагирует.
41. Стандартные электродные потенциалы. Направление протекания окислительно восстановительных реакций.
Стандартный электродный потенциал-это потенциал электрода при стандартных условиях, его обозначают символом Е°.
Окислительно-восстановительная реакция будет самопроизвольно протекать в таком направлении, при котором полуреакция с более высоким значением окислительно-восстановительного потенциала выступает в качестве окислителя по отношению к полуреакции с более низким потенциалом.
Стандартные электродные потенциалы
| Уравнение электродного процесса | Стандартный потенциалЕ при 25С, В |
| Li+ + eLi | –3,045 |
| Rb+ + eRb | –2,925 |
| K+ + e K | –2,924 |
| Cs+ + e Cs | –2,923 |
| Ca+2 + 2e Ca | –2,866 |
| Na+ + eNa | –2,714 |
| Mg2+ + 2eMg | –2,363 |
| Al3+ + 3eAl | –1,663 |
| Ti2+ + 2eTi | –1,630 |
| Mn2+ + 2eMn | –1,179 |
| Zn2+ + 2eZn | –0,763 |
| Cr3+ + 3eCr | –0,744 |
| Fe2+ + 2eFe | –0,440 |
| Cd2+ + 2eCd | –0,403 |
| Co2+ + 2eCo | –0,277 |
| Ni2+ + 2eNi | –0,250 |
| Sn2+ + 2eSn | –0,136 |
| Pb2+ + 2ePb | –0,126 |
| Fe3+ + 3eFe | –0,037 |
| 2H+ + 2e H2 | 0,000 |
| Bi3+ + 3eBi | 0,215 |
| Cu2+ + 2eCu | 0,337 |
| Ag+ + eAg | 0,799 |
| Hg2+ + 2eHg | 0,850 |
| Pt2+ + 2ePt | 1,188 |
| Au+ + eAu | 1,692 |
Направление ОВР можно определять по электродвижущей силе реакции(ΔЕ), которая связана с изменением энергии Гиббса реакции ΔG соотношением:
-ΔG=nFΔE
n–число электронов;F – постоянная Фарадея(9,65 * 104 Кл/моль)
Дата добавления: 2015-04-21; просмотров: 277; Мы поможем в написании вашей работы!; Нарушение авторских прав |