
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Законы — начала термодинамики
Традиционно считается, что термодинамика основывается на четырёх законах (началах), которые сформулированы на основе экспериментальных данных и поэтому могут быть приняты как постулаты.
* 0-й закон — нулевое начало термодинамики: Постулирует существование термодинамического равновесия и вводит понятие абсолютной температуры.
Термодинамическое равновесие. Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает. Если две изолированные системы  и
и 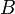 приведены в контакт друг с другом, то после достижения термодинамического равновесия полной системой
приведены в контакт друг с другом, то после достижения термодинамического равновесия полной системой  системы
системы  и
и 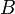 находятся в состоянии теплового (термического) равновесия друг с другом. При этом каждая из систем
находятся в состоянии теплового (термического) равновесия друг с другом. При этом каждая из систем  и
и 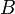 в отдельности также находится в состоянии термодинамического равновесия. Это равновесие не нарушится, если устранить контакт между системами, а затем восстановить его. Следовательно, если установление контакта между двумя системами
в отдельности также находится в состоянии термодинамического равновесия. Это равновесие не нарушится, если устранить контакт между системами, а затем восстановить его. Следовательно, если установление контакта между двумя системами  и
и 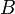 , которые до этого были изолированными, не приводит ни к каким изменениям, то эти системы находятся в тепловом равновесии друг с другом.
, которые до этого были изолированными, не приводит ни к каким изменениям, то эти системы находятся в тепловом равновесии друг с другом.
Закон транзитивности теплового равновесия. Если системы  и
и 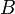 находятся в тепловом равновесии и системы
находятся в тепловом равновесии и системы 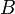 и
и  находятся в тепловом равновесии, то системы
находятся в тепловом равновесии, то системы  и
и  также находятся в тепловом равновесии между собой. На основании этого закона делается вывод о существовании абсолютной температуры как термодинамического параметра, обладающего свойствами эмпирической температуры, но не зависящего от способа её измерения. Равенство температур есть условие теплового равновесия систем (или частей одной и той же системы).
также находятся в тепловом равновесии между собой. На основании этого закона делается вывод о существовании абсолютной температуры как термодинамического параметра, обладающего свойствами эмпирической температуры, но не зависящего от способа её измерения. Равенство температур есть условие теплового равновесия систем (или частей одной и той же системы).
* 1-й закон — первое начало термодинамики: Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как
 ,
,
где  есть полный дифференциал внутренней энергии системы, а
есть полный дифференциал внутренней энергии системы, а  и
и  есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что
есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что  и
и  нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось.
нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось.
В литературе можно встретить и другие варианты приведённого выше соотношения, отличающиеся от него знаками (  или
или  ) перед
) перед  и
и  . Отличия вызваны тем, что конкретный вид этого уравнения зависит от соглашений, называемых «правилами знаков для работы и теплоты». Выше использовано «теплотехническое правило знаков для работы» (положительной считают работу, совершаемую системой, когда она отдаёт энергию, а отрицательной — работу, совершаемую над системой, когда она получает энергию) и «термодинамическое правило знаков для теплоты» (положительной считают теплоту, получаемую системой, а отрицательной — теплоту, отдаваемую системой). В «термодинамическом правиле знаков для работы» положительной считают работу, совершаемую над системой, а отрицательной — работу, совершаемую системой. Наконец, в «термохимическом правиле знаков для теплоты» положительной считают теплоту, отдаваемую системой, а отрицательной — теплоту, получаемую системой. Мнемоническое правило: в термодинамической системе знаков
. Отличия вызваны тем, что конкретный вид этого уравнения зависит от соглашений, называемых «правилами знаков для работы и теплоты». Выше использовано «теплотехническое правило знаков для работы» (положительной считают работу, совершаемую системой, когда она отдаёт энергию, а отрицательной — работу, совершаемую над системой, когда она получает энергию) и «термодинамическое правило знаков для теплоты» (положительной считают теплоту, получаемую системой, а отрицательной — теплоту, отдаваемую системой). В «термодинамическом правиле знаков для работы» положительной считают работу, совершаемую над системой, а отрицательной — работу, совершаемую системой. Наконец, в «термохимическом правиле знаков для теплоты» положительной считают теплоту, отдаваемую системой, а отрицательной — теплоту, получаемую системой. Мнемоническое правило: в термодинамической системе знаков  имеет тот же знак, что и энергия, передаваемая системе в виде работы или теплоты; в остальных случаях знак
имеет тот же знак, что и энергия, передаваемая системе в виде работы или теплоты; в остальных случаях знак  противоположен знаку передаваемой энергии. Стандарта, предписывающего использовать конкретный набор правил знаков, не существует, так что уместно рассматривать только степень распространённости того или иного правила в научной и учебной литературе. По этому поводу однозначно можно говорить лишь о том, что в современной литературе предпочитают использовать термодинамическое, а не термохимическое правило знаков для теплоты.
противоположен знаку передаваемой энергии. Стандарта, предписывающего использовать конкретный набор правил знаков, не существует, так что уместно рассматривать только степень распространённости того или иного правила в научной и учебной литературе. По этому поводу однозначно можно говорить лишь о том, что в современной литературе предпочитают использовать термодинамическое, а не термохимическое правило знаков для теплоты.
Иногда в рассматриваемое выражение для первого начала наряду с работой и теплотой включают ещё и работу переноса массы (химическую работу), выделяя её из общего выражения для работы в отдельное слагаемое.
* 2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
Приведем второе начало термодинамики в ещё одной формулировке Рудольфа Юлиуса Клаузиуса (1865): для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния  , называемая энтропией, такая, что ее полный дифференциал
, называемая энтропией, такая, что ее полный дифференциал  . [3]
. [3]
2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
* 3-й закон — третье начало термодинамики: Теорема Нернста: энтропия любой равновесной системы при абсолютном нуле температуры всегда равна нулю (традиционная формулировка). Здесь важно различать аксиомы, отражающие законы природы, и имеющие исторические корни соглашения, необходимые для построения шкалы измерения соответствующей термодинамической величины. Так, аксиомами являются утверждения, что и энтропия, и температура есть односторонне ограниченные величины, и что своих граничных значений обе величины достигают одновременно. Согласно стандартным соглашениям принято, что и энтропия, и температура ограничены снизу, т. е. не могут быть меньше некоторых предельных значений. Из этого логично вытекают следующие соглашения, согласно которым наименьшее значение энтропии принято равным нулю, а наименьшее (нулевое) значение температуры служит реперной точкой для построения термодинамической шкалы температур.
Дата добавления: 2015-04-21; просмотров: 787; Мы поможем в написании вашей работы!; Нарушение авторских прав |