
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Крива охолодження чистого метала
Лекція 1
Тема: "Кристалічна будова металів, процес кристалізації".
План лекції
1 Вступ до предмету.
2 Типи кристалевих граток.
3 Криві охолодження чистих металів.
4 Механізм кристалізації.
5 Особливості дендритної будови вилитого метала.
6 Анізатропія.
7 Алотропія.
1 Вступ до предмету
Матеріалознавство – це наука, яка вивчає металічні та неметалічні матеріали, залежність їх властивостей від хімічного складу, структури, методів обробки та умов єксплуатації.
Мета – вивчення властивостей матеріалів в залежності від складу та обробки, методів їх зміцнення, а також створення матеріалів з заданими властивостями. Такими властивостями є
- висока міцність і пластичність
- висока електропровідність або високий опір
- спеціальні магнітні властивості
- поєднання різних властивостей в одному матеріалі.
Основні задачі матеріалознавства
- розкрити фізичну сутність явищ, які проходять в матеріалах при впливі на них різних факторів в умовах виробництва та експлуатації
- встановити залежність між складом, будовою та властивостями матеріалів
- вивчити різні способи зміцнення матеріалів для підвищення високої надійності
- вивчити основні групи сучасних матеріалів, їх властивості та область використання
- знати про сучасні методи дослідження структури металів.
Як показує практика та наукові дослідження наявність тих чи інших властивостей визначається внутрішньою будовою сплавів.В свою чергу будова сплава залежить від складу та характера попередньої обробки.Таким чином можна встановити наступні звязки між характеристиками матеріала
| склад | обробка |
| будова |
| властивості |
З давніх часів метали завжди займали особливе місце. 83 із відомих 112 хімічних елементів таблиці Мєнделєєва Д. І. є металами. Всі метали ділять на чорні та кольорові.
Метали – один з класів конструкційних матеріалів, який характеризується визначеним набором властивостей
- металевий блиск
- пластичність
- висока теплопровідність
- висока електропровідність
- магнітні властивості
- постійна температура кристалізації
Дані властивості обумовлені особливостями будови металів. Згідно теорії металічного стану, метал являє собою речовину, яка складається з позитивних ядер, навколо яких по орбіталям обертаються електрони. На останньому рівні число електронів невелике і вони не міцно привязані до ядра. Ці електрони мають можливість пересуватися по всьому обєму метала.
Таким чином, пластичність, теплопровідність та електропровідність забезпечюуться наявністю "електронного газу".
Всі метали, які твердіють в нормальних умовах, являють собою кристалічні речовини, тобото укладання атомів в них характеризується визначеним порядком – періодичністю. Цей порядок визначається поняттям кристалічна решітка.
2 Типи кристалевих граток
Кристалічна будова характеризується закономірним, геометрична правильним розташуванням атомів (іонів) у просторі.
Атоми (іони) металу перебувають на такій регулярній відстані між собою, при якій енергія взаємодії позитивно і негативно заряджених частинок мінімальна. Якщо через центри атомів кристалу провести лінії, то отримаємо просторову ґратку, а якщо через ряди атомів провести площини, то утвориться безліч однакових елементарних геометричних фігур. Виділимо в просторовій гратці кристалу такий об'єм, що дає уявлення про будову всього кристалу і назвемо цей об'єм елементарною кристалічною коміркою.
Отже, елементарною кристалічною коміркою називається такий найменший об *см, який дає нам уявлення про взаємне розташування атомів у всьому кристалі. Переважна більшість металів має одну з перелічених нижче елементарних кристалічних комірок:
- кубічну об'ємноцентровану;
- кубічну гранецентровану;
- гексагональну щільноукладену.
Кристалічну комірку зображають вузлами (точками), що відповідають положенню центрів атомів у стані спокою, сполучених уявними прямими лініями.
В елементарній кристалічній комірці об'ємноцентрований куб (ОЦК) (рис.а) вісім атомів розташовано на перетині ребер куба і один— на перетині його діагоналей. Названу будову (ОЦК) мають метали: калій, натрій, титан, тантал, вольфрам, ванадій, а-залізо, хром та інші.
Елементарну кристалічну комірку характеризують: параметр, число атомів, що припадає на одну елементарну комірку, коефіцієнт компактності та координаційне число.
Параметр кристалічної комірки—величина, яка визначає її лінійні розміри. Очевидно, що для кубічної комірки параметром є довжина ребра куба а, яка вимірюється в нанометрах (нм). Один манометр 1 нм = 10-9м. Для металів з кубічною елементарною коміркою значення а знаходиться в межах 0,2.. .0,6 нм.

|
Рис 1 – Типи кристалевих граток
Елементарна кристалічна комірка гранеііентрований куб (ГЦК)(рис.б) має вісім атомів на перетині ребер і шість атомів— на перетині діагоналей граней куба. Таку будову мають: свинець, нікель, срібло, золото, платина, у-залізо та інші метали.
У гексагональній щільноукладеній комірці (ГЩК) (рис.в) атоми розташовані в кутах і в центрі основ шестигранної призми, а три атоми – між її основами. Таку будову мають: магній, цинк, берилій.
Параметрами ГЩК є її висота с і довжина грані а.
3 Криві охолодження чистих металів
Будь яка речовина може знаходитися у трьох агрегатних станах твердому, рідкомі та газоподібному.
Розглянемо перехід метала з рідкого стану в твердий.
При нагріві всіх кристалічних тіл спостерігається чітка межа переходу з твердого стану в рідкий. Така ж межа існує при переході з рідкого стану в твердий.
Кристалізація - це процес утворення ділянок кристалічної решітки в рідкій фазі та ріст кристалів з утворених центрів.
Процесс переходу метала з рідкого стану в кристалічний можна зобразити кривою в координатах час-температура.
Крива охолодження чистого метала
До точки 1 охолоджується метал в рідкому стані, процес супроводжується повільним зниженням температури. На ділянці 1-2 проходить процес кристалізації, який супроводжується виділенням тепла, яке називається прихованою теплотою кристалізації. Воно компенсує розсіювання теплоти в простір, і тому температура залишається постійною. Після закінчення кристалізації в точці 2 температура знову починає знижуватися, метал охолоджується в твердому стані.

Для кривої нагріву чистого металу намалювати навпаки.
4 Механізм кристалізації
Процес кристалізації складається з двох елементарних процесів. Перший процес заключається в зародженні дрібних часток кристалів, які називаються зародками або центрами кристалізації. Другий процес це ріст кристалів з цих центрів.
Модель кристалізації метала в перші 7 секунд охолодження представлена схемою процеса кристалізації (7 квадратиків) та кінетичною кривою кристалізації


В процесі розвитку кристалізації в ньому приймають участь все більша і більша кількість кристалів. Тому процес спочатку прискорюється, доки в якийсь момент взаємне зіткнення зростаючих кристалів починає помітно перешкоджати їх росту. Ріст кристалів вповільнюється ще й тому, що кількість рідини, в якій утворюються нові кристали, стає все менше. В процесі кристалізації, доки кристал оточений рідиною, він має правильну форму, але при зіткненні та зростанні кристалів їх правильна форма порушується. Зовнішня форма кристала виявляється залежною від умов доторкання зростаючих кристалів. Ось чому кристали метала –зерна не мають правильної форми.
Швидкість всього процеса кристалізації кількісно визначається двома величинами....Швидкістю виникнення центрів кристалізації та швидкістю роста кристалів (рис).

Значення оптимального переохолодження по досягненні максимальної швидкості кристалізації (ШК) та до утворення максимального числа центрів кристалізації (ЧЦ) не співпадають.
Розмір кристалів залежить від співвідношення ШК та ЧЦ. При великому значенні ШК та малому значенні ЧЦ утворюється мало великих кристалів. При малих значеннях ШК та великих ЧЦ утворюється велика кількість дрібних кристалів.
Розмір зерна визначають за формулою
N = k Ö ШК / ЧЦ,
Де N – розмір зерна;
k – коефіціент пропорційності;
СК – швидкість кристалізації;
ЧЦ – число центрів кристалізації
Мінімальний розмір здатного до зростання зародка називається критичним розміром зародка.
5 Особливості дендритної будови вилитого метала
Типова стуктура виливка складається з трьох зон
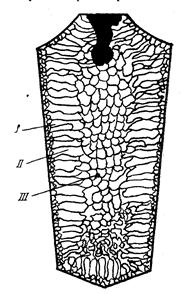
Рис2. Схема будови стального виливка
Перша зона – зовнішня дрібнозерниста корка 1, яка складається з дезорієнтованих дрібних кристалів. При першому контакті метала зі стінками виливниці виникає різкий градієнт температур і як наслідок явище переохолодження, що призводить до утворення великої кількості центрів кристалізації. В результаті корка отримує дрібнозернисту структуру.
Друга зона – зона стовпчатих кристалів (дендритів). Після утворення корки умови тепловідводу змнюються, градіент температур різко зменшується і як наслідок зменшується ступінь переохолодження сталі. В результаті з невеликої кількості центрів кристалізації починають рости нормально орієнтовані до поверхні корки стовпчасті кристали.
Третя зона – зона рівноосних кристалів. В центрі виливка вже нема визначеного напрямку віддачі тепла. Температура застигаючого метала вирівнюється в різних точках і рідина приймає вигляд кашеподібної суміші. В різних точках такої суміші утворюються зародки кристалів. Далі зародки ростуть за різними напрямами, зустрічаючись один з одним. В результаті цього процесу утворюється рівноосна структура.
Застосовуючи різні технологічні прийоми можна змінити кількісне співвідношення зон або виключити зі структури виливка будь-яку зону взагалі 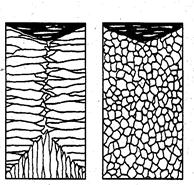
а б
Рис3. Схеми макроструктур слитков: а – столбчатые кристаллы;
б – равноосные кристаллы
Наприклад, перегрів сплавів перед розливкою та швидке охолодження при кристалізації призводять до формування структури, яка складається майже з одніх стовпчастих кристалів. Така структура називається транскристалічною. Таку структуру мають виливки дуже чистх металів. Але виливки з такою структурою дуже крихкі.
На практиці для подрібнення структури металів і сплавів широко застосовують технологічну операцію, яка називається модифікування. Це введення в рідкий сплав перед розливкою спеціальних добавок (модифікаторів).
Виливки мають неоднорідний склад. Неоднорідність сплава по хімічному складу, структурі та неметалевим включенням, яка виникає при кристалізації, називається ліквацією. Вона негативно впливає на механічні властивості.
Рідкий метал має більший обєм, ніж закристалізований, тому залитий в форму метал в процесі кристалізації зменшується в обємі, що призводить до утворення порожнин, так називаємих усадкових раковин.
6 Анізатропія
Властивості тіла залежать від природи атомів, з яких воно складається, та від сили взаємодії між цими атомами.
Сили взаємодії між атомами в значній мірі визначаються відстанями між ними.
В аморфних тілах з хаотичним розташуванням атомів в просторі відстані між атомами в різних напрямах рівні, тому властивості будуть однакові, тобто аморфні тіла ізотропні.
В кристалічних тілах атоми правильно розташовуються в просторі, причому за різними напрямами відстані між атомами неоднакові, що визначає відмінності в силах взаємодії між ними і як наслідок, різні властивості. Залежність властивостей від напряму називається анізатропієй.
7 Алотропія
Здатність деяких металів існувати в різних кристалічних формах в залежності від зовнішніх умов (тиск, температура) називається алотропія або поліморфізм.
Кожний вид решітки являє собою алотропічне видозмінення або модифікацію.
Прикладом алотропічного видозмінення в залежності від температури є залізо
Fe:  – ОЦК -
– ОЦК -  ;
;
 – ГЦК -
– ГЦК - 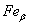 ;
;
 – ОЦК -
– ОЦК -  ; (высокотемпературное
; (высокотемпературное  )
)
Перетворення однієї модифікації в іншу протікає при постійній температурі та супроводжується тепловим ефектом. Видозміни елемента позначаються літерами грецького алфавіту у вигляді індекса біля основного позначення металла.
Прикладом алотропічного перетворення, обумовленого зміною тиску, є вуглець. При низькому тиску утворюється графіт, а при високому-алмаз.
Використовуючи явище поліморфізма можна зміцнювати або навпаки сплави за допомогою термічної обробки.
Дата добавления: 2015-02-09; просмотров: 535; Мы поможем в написании вашей работы!; Нарушение авторских прав |