
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПОСЛЕУБОЙНЫЕ ИЗМЕНЕНИЯ В ЖИВОТНЫХ ТКАНЯХ
Смерть убойных животных наступает вследствие их обескровливания, после чего в организме развивается комплекс посмертных изменений. Для мышечной ткани наиболее важными из них являются охлаждение, развитие посмертного окоченения и автолиз.
Снижение температуры тела убитого животного до температуры внешней среды вследствие прекращения выработки тепла организмом идет в определенной последовательности. Вначале охлаждаются конечности и голова, наружные, затем глубокие участки туши.
Окоченение туши - это послеубойное посмертное затвердение мышц и связанная с этим неподвижность суставов. Прежде всегооно обнаруживается в жевательных мышцах, мышцах шеи и передних конечностей, что объясняется их активной прижизненной деятельностью. Окоченение быстрее наступает и более выражено у туш с развитой мускулатурой, оно во многом зависит от состояния организма до убоя.
После убоя животного в его организме развивается целый комплекс самопроизвольных ферментативных процессов, сопровождающихся распадом тканевых компонентов мяса и влияющих на его качественные характеристики (механическую прочность, уровень водосвязывающей способности, вкус, цвет, аромат, устойчивость к микробиологическим процессам и т.д.).
Автолиз (греч. - саморастворение) - распад тканей, при котором происходит деструкция клеточных белков, углеводов и жиров под воздействием собственных ферментов клеток. Развитие автолитических процессов в мышечной ткани убитых животных приводит к формированию комплекса специфических изменений, известных в мясной промышленности под названием "созревание".
Изменение свойств мяса происходит в определенной последовательности в соответствии с основными этапами автолиза: парное мясо —> посмертное окоченение (Rigor mortis) —> разрешение посмертного окоченения и созревание (глубокий автолиз).
Качественные показатели мяса при этом существенно отличаются. Парное мясо (3-4 ч после убоя) имеет пластичную консистенцию и высокую водосвязывающую способность. В течение первых суток после убоя развитие посмертного окоченения приводит к резкому снижению водосвязывающей способности, росту механической прочности, снижению рН от 6,5-7,0 до 5,5-5,6, отсутствию выраженных вкуса и аромата. На стадиях созревания мясо частично восстанавливает свои свойства, хотя и не достигает уровня парного. После двух и более суток хранения у мяса существенно улучшаются все характеристики, причем увеличение температуры среды ускоряет процесс созревания. Так, например, для крупного рогатого скота при температуре, близкой к нулю, окоченение наступает через 18-24 ч, свиней - 16-18 ч, кур - 2-4 ч. Окоченение вдвое быстрее развивается при 15-18 ч, а при 37 °С -в четыре раза.
Механизм сокращения мышечных волокон в период окоченения сходен с механизмом их сокращения при жизни, однако имеются и существенные различия. Вместо организованного и регулируемого сокращения группы волокон под влиянием нервного импульса они беспорядочно сокращаются по всему объему мышц. Процесс протекает несинхронно, отдельные волокна находятся в разной стадии сокращения. Неравномерность перехода в сокращенное состояние обнаруживается даже по длине одного и того же волокна - одна часть его может быть расслаблена, тогда как другая - сокращена. В структуре волокон развивается большое напряжение, которое выражается в появлении признаков их внутреннего строения. Число сокращенных волокон нарастает и достигает максимума в момент наиболее интенсивного посмертного окоченения.
В основе автолитических превращений мяса лежат изменения углеводной системы, системы ресинтеза АТФ и состояния миофибриллярных белков, входящих в систему сокращения.
В связи с отсутствием поступления кислорода в организм ресинтез гликогена в мясе после убоя идти не может, и начинается его анаэробный распад, который протекает по пути фосфоролиза и амилолиза с образованием молочной кислоты и глюкозы, а также глюкозо-1-фосфата, глюкозо-6-фосфата и др. Совершается незначительный гидролитический распад гликогена за счет различных гликозидаз саркоплазмы. Интенсивный прижизненный распад гликогена может вызывать стрессовые ситуации у животных. После убоя животных в мясе скорость гликолиза можно регулировать. Например, введение хлорида натрия в парное мясо подавляет процесс; применение электростимуляции - ускоряет. Это широко применяется в практике производства мясопродуктов.
Через 24 ч гликолиз приостанавливается вследствие исчерпания запасов АТФ и накопления молочной кислоты, подавляющей фосфоролиз.
Ферментативный распад гликогена является пусковым механизмом для последующих физико-химических и биохимических процессов. Накопление молочной кислоты приводит к смещению рН мяса в кислую сторону от 7,2-7,4 до 5,4-5,8, в результате чего:
- увеличивается устойчивость мяса к действию гнилостных микроорганизмов;
- снижается растворимость мышечных белков (их изоэлек-трическая точка при рН 4,7-5,4), уровень их гидратации, водосвязывающей способности;
- происходит набухание коллагена соединительной ткани;
- повышается активность катепсинов (оптимум рН 5,3), вызывающих гидролиз белков на более поздних стадиях автолиза;
- разрушается бикарбонатная система мышечной ткани с выделением углекислого газа;
- создаются условия для интенсификации реакций цветообразования вследствие перехода в миоглобине двухвалентного железа в трехвалентное;
- формируются предшественники вкуса и ароматамяса;
- активизируется процесс окисления липидов. Молекулярная основа процесса такова: поперечные связи между филаментами актина и миозина сохраняются и не могут разорваться из-за отсутствия АТФ. Активный транспорт Са2+ в саркоплазматический ретикулум оказывается невозможным, так же как и переход миозина в активированное состояние (конформация миозин - АДФ•Фн). По этой причине продукты гидролиза АТФ (АДФ и Фн) удаляются не вследствие образования комплекса актин - миозин - АДФ•Фн, а диффузией. При этом не совершаются соответствующие конформационные переходы в рабочих элементах клетки, а, следовательно, взаимодействие актин - миозин остается. Акто-миозиновый комплекс можно разрушить, приложив внешнюю силу, но восстановить потом нельзя.
Мясо в стадии окоченения, обладающее минимальной влагоудерживающей и влагосвязывающей способностями, имеет существенные ограничения по применению. Ввиду того, что этот период характерен накоплением кислых продуктов небелковой природы (табл. ), то анализ рН, углеводных фракций и неорганического фосфора может быть успешно использован в исследовательской практике при определении стадии автолитических превращений в мясе.
Таблица 12. Динамика изменениярН содержания углеводных фракций и неорганического фосфора в мышечной ткани говядины
| Продолжитель-ность хранения, ч | рН мышеч-ной ткани | Содержание, мг % | |||
| Гликоге-на в пересче-те на глюкозу | Глюкозы | Молоч-ной кислоты | Неорга-нического фосфора | ||
| 6,21 | |||||
| 5,94 | |||||
| 5,56 | |||||
| 5,68 | |||||
| 5,82 | |||||
| 5,68 | |||||
| 5,75 |
Сроки созревания мяса зависят от вида животного, части туши, упитанности, температурного режима хранения.
Как правило, в мясе с нормальным развитием автолиза его нежность и водосвязывающая способность достигают оптимума через 5-7 сут хранения при 0-2 °С, органолептические показатели - к 10-14 сут. В связи с этим целесообразная продолжительность созревания мяса обусловлена способом дальнейшего технологического использования сырья.
Сырье с 13-15-суточным периодом созревания пригодно для изготовления практически всех видов колбас, полуфабрикатов и соленых изделий.
Наилучший вид сырья для производства натуральных полуфабрикатов - мясо с периодом выдержки 7-10 сут созревания. Парное мясо рекомендуется использовать для производства эмульгированных (вареных) колбас и соленых изделий из свинины. Белки парного мяса обладают наибольшей влагосвязывающей и эмульгирующей способностью, развариваемость коллагена максимальна. Эти обстоятельства предопределяют высокий выход готовой продукции и снижают вероятность образования дефектов при тепловой обработке. В первые часы после убоя мясо бактерицидно и содержит незначительное количество микроорганизмов. С экономических позиций применение парного мяса также даёт существенные преимущества вследствие снижения потребности в объемах холодильных камер и связанных сих эксплуатацией энергетических затрат.
Однако работа с парным мясом требует как высокой оперативности в технологическом процессе (интервал от момента убоя до стадии термообработки готовых изделий не должен превышать 3 ч), так и применения специальных приёмов, направленных на задержку гликолиза и процесса взаимодействия актина с миозином. В частности, такими способами являются:
- быстрое замораживание обваленного парного мяса (без или после предварительного измельчения) путем введения твердой углекислоты;
- обвалка парного мяса, быстрое измельчение и посол с введением 2-4 % хлорида натрия;
- введение рассолов через кровеносную систему одновременно с обескровливанием при убое животных;
- инъецирование рассолов в отруба непосредственно после разделки парных туш;
- применение сублимационной сушки парного мяса.
Указанные приемы дают возможность устранить или свести до минимума развитие и последствия посмертного окоченения.
В настоящее время вопрос направленного использования сырья с учетом хода автолиза приобретает особое значение, так как существенно возросла доля животных, поступающих на переработку с промышленных комплексов, у которых после убоя в мышечной ткани обнаруживаются значительные отклонения от обычного развития автолитических процессов, причину возникновения которых связывают с прижизненным стрессом.
В соответствии с этим различают мясо с высоким конечным рН (DFD) и экссудативное мясо (PSE). Мясо с признаками DFD имеет через 24 ч после убоя уровень рН выше 6,3, темную окраску, грубую структуру волокон, обладает высокой водосвязывающей способностью, повышенной липкостью и обычно характерно для молодых животных крупного рогатого скота, подвергавшихся различным видам длительного стресса до убоя. Вследствие прижизненного распада гликогена, количество образовавшейся после убоя молочной кислоты в мясе таких животных невелико и миофибриллярные белки в мясе DFD имеют хорошую растворимость.
Высокие значения рН ограничивают продолжительность его хранения, в связи с чем мясо DFD непригодно для выработки сырокопченых изделий. Однако, благодаря высокой влагосвязывающей способности, его целесообразно использовать при производстве вареных колбас, соленых изделий, быстрозамороженных полуфабрикатов.
Мясо PSE характеризуется светлой окраской, мягкой рыхлой консистенцией, выделением мясного сока вследствие пониженной водосвязывающей способности, кислым привкусом. Признаки PSE чаще всего имеет свинина, полученная от убоя животных с интенсивным откормом и ограниченной подвижностью при содержании. Появление признаков PSE может быть обусловлено также генетическими последствиями, воздействием кратковременных стрессов, чрезмерной возбудимостью животных. Наиболее часто мясо с признаками PSE получают в летний период времени. В первую очередь экссудативности подвержены наиболее ценные части туши:
длиннейшая мышца и окорока. После убоя таких животных в мышечной ткани происходит интенсивный распад гликогена, посмертное окоченение наступает быстрее. В течение 60 мин рН мяса понижается до 5,2-5,5, однако, поскольку температура сырья в этот период сохраняется на высоком уровне, происходит конформация саркоплазматических белков и их взаимодействие с белками миофибрилл.
Мясо с признаками PSE из-за низких рН (5,0-5,5) и водо-связывающей способности непригодно для производства вареных колбас, вареных и сырокопченых окороков, так как при этом ухудшаются органолептические характеристики готовых изделий (светлая окраска, кисловатый привкус, жесткая консистенция, пониженная сочность), снижается выход. Однако, в сочетании с мясом хорошего качества либо с соевым изолятом или другими белками оно пригодно для переработки в эмульгированные и сырокопченые колбасы, рубленые и панированные полуфабрикаты и другие виды мясных изделий.
Контроль качества сырья, получаемого при первичной переработке скота, осуществляют путем определения величины рН мяса через 1-2 ч после убоя. При этом в ряде стран дополнительную сортировку сырья на категории ведут с учетом уровня рН: I - 5,0-5,5; II - 5,6-6,2; Ш - 6,3 и выше.
В норме же мясо убойных животных претерпевает характерные изменения в соответствии с периодами, отмеченными выше. Развитие гликолитических процессов в мясе в послеубойный период определяет последующую направленность ферментативных процессов и связанное с этим состояние белковых веществ. Изменения белков мяса не протекают изолированно, они тесным образом связаны с изменениями других составляющих компонентов. Наиболее характерные изменения мышечной ткани в послеубойный период обусловлены посмертным окоченением вследствие сокращения мышц. Превращения белков двигательного аппарата клетки (миофибрилл) тесно связаны с механизмом синтеза и распада АТФ.
В начальный период после убоя мышцы животных характеризуются высоким содержанием АТФ - они расслаблены. С развитием автолитических процессов содержание АТФ есть суммарный результат ее распада и синтеза. Основным источником синтеза АТФ в этот период является анаэробный распад гликогена, а также глюкозы, образующейся в процессе амилолиза. Особенно интенсивно образование АТФ протекает в первые часы убоя, когда энергетический баланс мало отличается от прижизненного.

Рисунок 55. источники энергии для работы мышцы.
В суммарный итог синтеза АТФ вносит вклад реакция между креатинфосфатом и АДФ:
АДФ + КРФ АТФ + КР
Однако образование креатинфосфата возможно лишь в аэробных условиях, и поэтому синтез АТФ лимитируется начальным прижизненным количеством креатинфосфата. В связи с этим миозин имеет возможность взаимодействия сАТФ, что является причиной сохранения свойств мышечной ткани в первые часы автолиза. Однако в целом суммарная скорость распада АТФ превышает скорость ее синтеза. Это дает сигнал к началу автолитических изменений белков и развитию окоченения. В связи с этим анализ АТФ и продуктов ее распада в мясе также может использоваться в исследовательской практике.
Сущность дальнейших изменений в основном связана с процессом образования актомиозинового комплекса, скорость нарастания которого зависит от наличия в системе энергии и ионов кальция (Са2+). Непосредственно после убоя ионы кальция связаны с саркоплазматической сетью мышечного волокна, актин находится в глобулярной форме и не связан с миозином. Сдвиг рН мяса в кислую сторону запускает механизм превращений миофибриллярных белков:
- изменяется проницаемость мембран миофибрилл;
- ионы кальция выделяютсяиз каналов саркоплазматического ретикулума, концентрация их возрастает, под их действием повышается АТФ-азная активность миозина;
- глобулярный Г-актин переходит в фибриллярный (Ф-актин), способный вступать во взаимодействие с миозином в присутствии энергии распада АТФ;
- энергия распада АТФ инициирует взаимодействие миозина с фибриллярным актином с образованием актомиозинового комплекса.
Максимум посмертного окоченения в зависимости от вида животных и внешних условий наступает к 18-24 ч.
Максимальное падение растворимости миофибриллярных белков, наблюдаемое на первые-вторые сутки в охлажденном мясе, взаимосвязано с распадом АТФ, изменением рН среды и свидетельствует о наступлении в этот период посмертного окоченения ткани. В дальнейшем одной из причин повышения экстрагируемости миофибриллярных белков является протеолитическая деструкция миозиновых агрегатов.
При разрешении окоченения агрегационные процессы тормозятся, и наблюдается перераспределение катионов и анионов электролитов клетки и межклеточной жидкости, что приводит к повышению водоудерживающей способности, эластичности и гибкости мышечной ткани.
В процессе разрешения окоченения наблюдается удлинение саркомеров вследствие увеличения длины изотропных дисков. Саркомеры миофибрилл удлиняются до первоначальной величины и более, при одновременном уменьшении в диаметре. В этот период ослабляются агрегационные взаимодействия белковых макромолекул, повышается экстрагируемость белков и реактивность различных функциональных групп миофибриллярных белков, что в значительной степени обусловлено протеолитическои деструкцией.
Большинство мышечных волокон в этот период расслаблено Причина и механизм этого явления еще недостаточно ясны. Очевидно, это связано с ослаблением поперечных связей между актином и миозином с последующей диссоциацией комплекса. Полное диссоциации комплекса не происходит, однако частичного распаде миозин - актин достаточно, чтобы волокна растянулись.
Изменения свойств белков, предшествующие релаксации мышцы, тесно связаны с деятельностью лизосомальных протеолитических ферментов - катепсинов, которые во втором периоде автолиза освобождаются из лизосом и активируются кислой реакцией среды клетки, Катепсины - гетерогенный комплекс, разделяющийся на фракции (А, В. С. Д, Е), которые отличаются специфичностью к гидролизу белковых субстратов, молекулярной массой, рН-оптимумом действия, отношением к ионам хлора и др. свойствами. Действуя на разные субстратные фрагменты катепсины оказывают существенное влияние на структуру белковых компонентов. Это вносит вполне определенный вклад в диссоциацию образовавшихся белковых агрегатов, ведет к появлению свободных гидрофильных групп и частичному восстановлению свойств мышечной ткани, утраченных в результате окоченения.
Важным и завершающим послеубойным процессом является созревание мяса, в результате которого оно приобретает сочность, характерные вкус и аромат. Образование вкусо- и ароматообразующих компонентов происходит благодаря автолитическим превращениям белков, липидов, углеводов, нуклеотидов идругих составных частей мяса. Скорость накопления потенциальных предшественников вкуса и аромата, букет которых формируется в процессе кулинарной обработки, зависит от условий хранения мяса, главным образом от температуры, и сопряжена ее скоростью деградации высокомолекулярных веществ мышечной ткани, особенно белков.
В первый период созревания, когда развиваются агрегационные взаимодействия и наступает окоченение. вкус и аромат минимальны. С нарастанием протеолитической активности катепсинов внутри клетки и в связи с деструкцией белков во втором периоде созревания нарастают низкомолекулярные продукты гидролиза - аминокислоты и пептиды, что также может служить мерой глубины автолитических превращений в мясе. Накопление продуктов распада белков достаточно отчетливо отмечается после 48 ч и достигает максимума на 5-7 сут. Именно в это время интенсифицируется образование вкуса и аромата, которое достигает максимума на 10-14 сут при низких положительных температурах хранения.
Основными компонентами при формировании вкуса и аромата являются аминокислоты и амиды гистидин, глутаминовая и аспарагиновая кислоты, глутамин, глицин, треонин, фенилаланин, лейцин и другие. Эти вещества образуются и накапливаются в процессе автолиза при распаде белков, а также пептидов, относящихся к экстрактивным веществам мышечной ткани (глютатион, карнозин, ансерин).
Поскольку автолитические изменения мышечной ткани тесно связаны с распадом углеводной, жировой и нуклеотидной систем мяса, то параллельно накоплению продуктов распада белков увеличивается содержание свободных моносахаридов, которые, как известно, обладают вкусом: глюкоза - образуется при распаде гликогена, галактоза появляется в результате распада липидной системы из цереброзидов, пентозы являются одним из конечных продуктов распада клеточных нуклеиновых кислот и нуклеотидов.
О развитии автолитических превращений можно судить по активности катепсинов - тканевых лизосомальных ферментов, привносящих вклад в изменения структуры и свойств мяса. Специфическая активность внутритканевых протеолитических ферментов в отношении белковых субстратов в ходе автолиза мышечной ткани обеспечивает формирование необходимой консистенции мясного сырья, накопление низкомолекулярных предшественников вкуса и аромата, обусловливая пищевую ценность получаемых на его основе продуктов. Обычно используют метод органолептической оценки, сравнительная характеристика мяса в соответствии с которым представлена в таблице .
В технологической практике нет установленных показателей полной зрелости мяса, так как различные свойства формируются при созревании не одновременно. О пригодности мяса для конкретных целей судят по свойствам и показателям, имеющим для данной цели решающее значение.
По растворимости фракции миофибриллярных белков можно судить о посмертных изменениях в процессе автолитических превращений, которые являются фоном в образовании специфических свойств сырья.
Таблица 13. Органолептическая оценка мяса на разных стадиях автолиза
| Наименование продукта | Несозревшее мясо | Созревшее мясо |
| Вареное мясо | Жесткое, сухое, отсутствует специфический приятный вкус и аромат | Нежное, сочное, со специфическим приятным вкусом и запахом |
| Бульон | Мутный, отсутствует специфический приятный вкус и аромат бульона | Прозрачный, со специфическим приятным вкусом и ароматом |
В свежей мышечной ткани растворимость миофибриллярных белков максимальна, поскольку актин и миозин существуют раздельными фракциями. Мышца в результате этого расслаблена, имеет высокую гидрофильность. С развитием автолитических процессов в период посмертного окоченения актин и миозин образуют комплекс, мышца укорачивается, теряет влагу и отмечается уменьшением растворимости мышечных белков, а затем, после достижения определенного минимума, экстрагируемость повышается. В этот период автолиза мышц млекопитающих и птиц для всех белков характерны связанные с изменением зарядов конформационные сдвиги, стимулирующие агрегационные взаимодействия белков. Характер этих изменений для однотипных белков разных мышц неодинаков и соответствует интенсивности накопления кислот (продуктов автолиза небелковой природы). Поэтому и извлекаемость однотипных белков разных мышц при одинаковых условиях автолиза различна. Наибольшее снижение экстрагируемых белков саркоплазмы выявляется у мышц, в которых интенсивно происходит накопление продуктов автолиза небелковой природы (фосфорной, молочной, пировиноградной кетокислот и др.). Действие этих продуктов обусловливает изменения, способствующие большему межмолекулярному взаимодействию белков. Взаимодействие белковых частиц в этот период, по-видимому, осуществляется в основном за счет электростатических сил, так как извлечение белков саркоплазмы буферными растворами физиологической концентрации с высокой диэлектрической постоянной повышает их экстрагируемость.
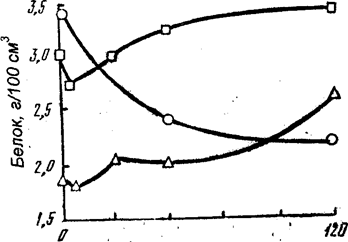
Рисунок 56. Суммарная экстрагируемость белков саркоплазмы при автолизе (4 °С) мышц: 1 - крупного рогатого скота; 2, 3 - соответственно белых и красных мышц кур.
Извлекаемость разных фракций белков саркоплазмы при автолизе уменьшается неодинаково. Наиболее заметно уменьшается экстрагируемость белков фракций глобулина Х и миоальбуминов. Свойства белков миогеновой группы изменяются меньше. У этих белков хорошо сохраняются растворимость и ферментативная активность. У высокомолекулярных белков изменения незначительны.
После достижения минимума (по времени для различных видов мышц неодинаково) в зависимости от интенсивности прошедших агрегационных взаимодействий и особенно величины протеолитической активности экстрагируемость и электрофоретическая подвижность белков саркоплазмы увеличиваются.
В начальных стадиях автолиза мышц уменьшается растворимость миозина в результате образования менее растворимого комплекса актомиозина. Актин довольно прочно удерживается в структуре миофибрилл, поэтому и связанный с ним миозин не извлекается без воздействия веществ, деполимеризующих акто-миозиновый комплекс. Уменьшение экстрагируемости миозина в автолизирующихся мышцах в этот период происходит за счет снижения концентрации АТФ (добавление к измельченным мышцам АТФ или пирофосфата восстанавливает растворимость миозина).
В процессе окоченения белки миофибрилл претерпевают конформационные изменения, способствующие интенсивным агрегационным взаимодействиям. Понижение экстрагируемости миофибриллярных белков продолжается до определенного периода. Например, в мышцах крупного рогатого скота до 24-48 ч автолиза, а для мышц птиц этот срок значительно меньше. Затем происходит повышение их растворимости за счет как диссоциации актомиозинового комплекса, так и ослабления агрегационных взаимодействий вследствие перераспределения зарядов. Одной из причин повышения экстрагируемости является также ограниченная протеолитическая деструкция миофибриллярных белков.
В процессе автолитических превращений происходит изменение водосвязывающей способности мышечной ткани.
Непосредственно после убоя животного мышечная ткань характеризуется высокой способностью к гидратации. В первый период автолиза водосвязывающая способность у разных видов мышц весьма специфично уменьшается: интенсивность уменьшения водосвязывающей способности и сроки наступления минимума, а затем последующего нарастания резко различаются. В мышцах с глубоким и длительным окоченением наблюдается также длительное и интенсивное уменьшение водосвязывающей способности. Интенсивность снижения водосвязывающей способности согласуется с особенностями изменений миофибриллярных белков, а также спецификой их агрегационных взаимодействий.
Наряду с миофибриллярными белками существенное влияние на водосвязывающую способность мышечной ткани оказывает характер изменений и остальных белков мышечной ткани. В начальных стадиях автолиза в результате подкисления большая часть белков мышечной ткани переходит в изоэлектрическое состояние, что способствует лучшей агрегации белков и уменьшению гидратационной способности. Поэтому как повышение, так и понижение рН среды от изоэлектрической точки белков (рН 5,5) приводит к повышению гидратации мышц.
С началом разрешения окоченения происходит постепенное повышение водосвязывающей способности мышц. При этом четко выявляется повышение активности гидрофильных групп в белках мышц, "разрыхление" белковых структур. Следует отметить, что активность свободных кислотных групп в белках мышц выявляется в большей степени, чем основных. Это объясняется тем, что белки мышц содержат больше дикарбоновых аминокислот (глютаминовой и аспарагиновой), чем диаминокислот (лизин и аргинин).
Таким образом, белки мышц являются главными связывающими воду соединениями.
В связи с изменением растворимости белков саркоплазмы и миофибрилл созревшее мясо при кулинарной обработке (варке) выделяет в воду меньше белка, и бульон получается прозрачным.
Уменьшение степени дисперсности белков и коагуляция их с образованием крупных частиц вызывают выделение мясного сока. Увеличение нежности мяса при созревании связано с набуханием белков стромы, главным образом коллагена, под воздействием кислот. При варке такой коллаген легче переходит в желатин.
Таким образом, определение глубины автолитических превращений возможно путем комплексного исследования химических и физико-химических показателей сырья, а также активности важнейших ферментов, например, катепсинов.
Проведенные гистологические и электронномикроскопические исследования в процессе автолиза при температуре 2-4 °С мяса животных, убой которых производился путем обескровливания, после оглушения током промышленной частоты, и сопоставление их результатов с данными, полученными другими методами исследования, показали тесную взаимосвязь между структурными и физико-химическими изменениями, так как последние в процессе автолиза мяса вызывают соответствующие микроструктурные изменения.
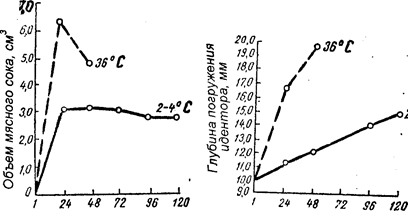
Продолжительность, ч Продолжительность, ч
Рисунок 57. Изменение свойств мяса в зависимости от длительности созревания: а - объем выделяемого сока; б - нежность мяса.
Макроскопически стадия послеубойной релаксации проявляется расслабленностью мышц туши животного, их эластичностью, беспрепятственной подвижностью суставов.
Гистологически у парного мяса, взятого в первые 1,5-3 ч после убоя животного, мышечные волокна расслаблены, набухшие, плотно прилегают друг к другу и имеют прямолинейные или слегка волнистые очертания. Границы волокон различимы лишь по расположенным под сарколеммой ядрам, имеющим палочковидную форму и зернисто-глыбчатую структуру хроматина. В мышечных волокнах отчетливо выражена крупная поперечная исчерчснность, продольная исчерченность сглажена (рис. 58).
При электронномикроскопических исследованиях мышечной ткани парного мяса наблюдается плотное прилегание миофибрилл друг к другу. Вследствие бочковидности А-дисков, обусловленной их набуханием, миофибриллы имеют вид своеобразных гирлянд. Хорошо выражены 1-диски. Изменений в структуре сарколеммы и ядер в этот период не установлено.

Рисунок 58. Мышечные волокна в стадии послеубойного расслабления.
В мышечных волокнах скапливается значительное количество АТФ за счет идущего ресинтеза АТФ и торможения ее распада, обусловленного отсутствием в волокнах диссоциированных ионов Са2+. В этот период они связаны структурами боковых тяжей продольного саркоплазматического ретикулума. Это оказывает на миофибриллярные белки пластифицирущее действие и обусловливает расслабление мышц, т.е. имеет место наличие актина и миозина, несвязанных в комплекс, что предопределяет высокую влагоудерживающую способность и целесообразность замораживания парного мяса для его использования при изготовлении ветчинных изделий, вареных колбас.
Наряду с общим расслаблением мышечных волокон в первые часы после убоя животного, в отдельных из них формируются узлы сокращения, представляющие собой локальные сверхсокращенные участки мышечных волокон. Образование узлов сокращения является в основном ответной реакцией мышечных волокон на чрезвычайные раздражители в виде механических повреждений (разрезов) при разделке туши.
Узлы сокращения образуются как в местах непосредственного повреждения - в местах разрезов и разрубов поперечнополосатой мышечной ткани, так и по ходу мышечных волокон в глубине мышц, и сохраняются в течение всего периода хранения мяса.
Узлы сокращения мышечных волокон в местах их поперечных разрезов имеют обычно грибовидную или тюльпановидную, а в глубине мускулов - овальную или прямоугольную форму (рис. 59).

Рисунок 59. Узлы сокращения: а - в месте ножевого сечения; б - в глубине мышечных волокон
Формирование развитых грибовидных и тюльпановидных узлов сокращения в местах поперечных разрезов мышечных волокон, возникающих при убое животного и разделке его туши в цехах первичной переработки скота, свидетельствует о высоком прижизненном тонусе мышц, присущем здоровым животным. У забитых больных животных образование узлов сокращения в участках поперечных разрезов мышечных волокон выражено слабо; если надрезы мышц произведены после смерти (с целью фальсификации), то узлы сокращений совершенно отсутствуют.
Поэтому наличие и выраженность этих образований является одним из важных диагностических признаков для определения состояния животного в момент убоя.
Признаки развития посмертного окоченения в скелетных мышцах туши начинают обнаруживаться чаще всего через 3 ч после убоя животного.
С развитием посмертного окоченения увеличивается сопротивление мышечной ткани растяжению и резанию, как у сырого, так и у вареного мяса. В максимуме окоченения мышечной ткани, характеризующемся минимальной водоудерживающей способностью и максимальной жесткостью, мясо наименее пригодно для промышленной переработки и кулинарной обработки.
Посмертное окоченение туши развивается с мышц шеи и постепенно распространяется на мышцы передних конечностей, грудные и брюшные мышцы, мышцы спины и, наконец, мышцы задних конечностей. В таком же порядке происходит и разрешение посмертного окоченения.
В основе развития посмертного окоченения лежит нарастающее сокращение мышечных волокон и некоторое укорочение длины соединительнотканных вследствие набухания их под действием накапливающейся в этот период в мышцах молочной кислоты.
В результате различий структуры мышечных волокон (белые, красные и переходные формы) и их энергетических запасов в развитии посмертного сокращения наблюдается определенная асинхронность, которая, однако, не влияет на общую тенденцию развития процессов посмертного окоченения.
Гистологически посмертное сокращение мышечных волокон выражается постепенным сближением, а затем ослаблением их поперечной исчерченности с одновременным усилением выраженности продольной исчерченности. В связи с различиями степени и синхронности сокращения отдельных мышечных волокон и некоторым укорочением длины соединительнотканных волокон в процессе развития посмертного окоченения, в мышцах в этот период наблюдается возникновение различного рода деформаций, придающих волокнам зигзагообразную, волнистую и другие формы.
Особенно сильно деформация мышечных волокон выражена в начале развития посмертного окоченения. Затем по мере увеличения общего количества сокращенных мышечных волокон деформированность их уменьшается.
В зависимости от характера и степени выраженности деформации мышечных волокон, а также степени их сокращения, в развитии посмертного окоченения различают три этапа.
Первый этап, начинающийся через 3-6 ч после убоя, характеризуется начальной степенью развития посмертного окоченения; деформация в мышцах проявляется зигзагообразной складчатостью волокон, большинство из которых наводятся еще в расслабленном состоянии.
Второй этап, начинающийся через 6-12 ч после убоя, характеризуется средней степенью развития посмертного окоченения. В этот период наряду с сохранившейся местами зигзагообразной волнистостью отмечается появление в отдельных мышечных волокнах значительных дугообразных и S-образных изгибов и различного рода выпячиваний. Встречается много сокращенных волокон, отличающихся прямолинейным расположением и сближенной поперечной исчерченностью.
Третий этап, начинающийся через 12-24 ч после убоя, характеризуется сильной степенью развития посмертного окоченения, в этот период происходит постепенное выпрямление мышечных волокон. При максимальном развитии посмертного окоченения сокращено наибольшее количество волокон, однако встречаются отдельные волокна еще не полностью сократившиеся или находящиеся уже в стадии расслабления. В целом поперечная исчерченность большинства мышечных волокон в это время сильно сближена и выявляется плохо. Мышечные волокна раздвинуты и между ними обнаруживаются небольшие пространства, в связи с чем хорошо выявляются границы волокон, ядра которых овальной формы с хорошо выраженной структурой хроматина.
Развитие каких-либо деструктивных изменений в соединительной ткани, в мышечных волокнах и в структуре ядер при посмертном окоченении гистологическим анализом не выявляется.
Разрешение посмертного сокращения происходит асинхронно. Оно выражается не только разной степенью растянутости отдельных мышечных волокон и их миофибрилл, но и смещением структурных элементов как между миофибриллами, так и в самих миофибриллах.
Полного распада актомиозина на актин и миозин ни после разрешения посмертного окоченения, ни в дальнейшем учеными не обнаружено. Полагают, что в этот период происходят локальные нарушения связей в структуре миофибрилл, которых оказывается достаточно для растяжения волокна в результате восстановления упругой деформации соединительнотканных структурных элементов.
Проведенные гистологические исследования подтвердили, что начиная со вторых суток после убоя животного при температуре хранения туш 2-4 °С, в мышечных волокнах постепенно происходит распад связей между актиновыми протофибриллами и структурами Z-пластинок, приводящий к нарастающей фрагментации миофибрилл. Распад связей в области Z-пластинок, по-видимому, и является одной из причин разрешения посмертного окоченения.
Изменения, характерные для созревшего мяса, начинают обнаруживаться с момента разрешения посмертного окоченения и усиливаются при хранении. Гистологический анализ обнаруживает локальные деструктивные процессы в мясе.
Микроструктурный анализ в исследовании автолитических процессов в мясе в настоящее время приобрел особую популярность, так как позволяет диагностировать состояние сырья до того, как это становится возможным физико-химическими методами. Весьма полезно в оценке автолитической стадии использовать анализ прочностных и других реологические характеристик мяса. Общая характеристика реологических и структурно-механических свойств продуктов, а также приборов для их контроля, рекомендуемых для использования в практике, приведены в приложении.
В связи с тем что мышцы мяса кислорода не получают и окислительные процессы в них заторможены, в мясе накапливаются избытки молочной и фосфорной кислоты. Так, например, при мышечном утомлении организма (при его жизни) достигается максимум 0,25% молочной кислоты, а при посмертном окоченении ее накопляется до 0,82%. Активная реакция среды (рН) при этом изменяется от 7,26 до 6,02. От накопления молочной кислоты наступает быстрое сокращение (окоченение) мускулатуры, сопровождающееся коагуляцией белка (Саксль). При этом актомиозин теряет свою растворимость, белки стабилизируются, а кальций выпадает из коллоидов белка и переходит в раствор (мясной сок). Вследствие избыточного содержания молочной кислоты вначале наступает набухание коллоидоанизотропного вещества (темного диска) мышечных волокон (оно сопровождается укорочением— окоченением мышц); затем по мере увеличения концентрации молочной кислоты и коагуляции белка происходит размягчение этого вещества. Свернувшиеся белки теряют свои коллоидные свойства, становятся неспособными связывать (удерживать) воду и в известной степени лишаются своей дисперсной среды (воды): вместо первоначального разбухания наступает сморщивание (съеживание) коллоидов клеток, и мышцы становятся мягкими (разрешение окоченения).
В результате накопления молочной, фосфорной и других кислот в мясе увеличивается концентрация водородных ионов, вследствие чего к концу суток рН снижается до 5,8—5,7 (и даже ниже).
В кислой среде при распаде АТФ, АДФ, АМФ и фосфорной кислоты происходит частичное накопление неорганического фосфора. Резко кислая среда и наличие неорганического фосфора считается причиной диссоциации актомиозинового комплекса на актин и миозин. Распад этого комплекса снимает явления окоченения и жесткости мяса. Следовательно, фазу окоченения от других фаз обособить нельзя и ее необходимо считать одним из этапов процесса созревания мяса.
Кислая среда сама по себе действует бактериостатически и даже бактерицидно, а поэтому при сдвиге рН в кислую сторону в мясе создаются неблагоприятные условия для развития микроорганизмов.
Наконец, кислая среда приводит к некоторым изменениям химического состава и физико-коллоидной структуры белков. Она изменяет проницаемость мышечных оболочек и степень дисперсности белков. Кислоты вступают во взаимодействие с протеинатами кальция и кальций отщепляют от белков.
Переход кальция в экстракт ведет к уменьшению дисперсности белков, в результате чего теряется часть гидратно связанной воды. Поэтому из созревшего мяса центрифугированием можно частично отделить мясной сок.
Высвободившаяся гидратносвязанная вода, воздействие про-теолитических ферментов и кислая среда создают условия разрыхления сарколеммы мышечных волокон, и в первую очередь разрыхления и набухания коллагена. Это в значительной степени способствует изменению консистенции мяса и более выраженной его сочности. Очевидно, с набуханием коллагена, а затем частичной отдачей влаги с поверхности туши в окружающую среду следует связывать образование на ее поверхности корочки подсыхания.
Фаза собственного созревания во многом определяет интенсивность течения физико-коллоидных процессов и микроструктурных изменений мышечных волокон, которые бывают в фазе автолиза. Автолиз при созревании мяса понижают в широком смысле слова и связывают его не только с распадом белков, но и с процессом распада любых составных частей клеток. В связи с этим процессы, происходящие в фазе собственного созревания, невозможно отделить или обособить от таковых при автолизе. Тем не менее в результате комплекса причин (действие протеолитических ферментов, резко кислая среда, продукты автолитического распада небелковых веществ и др.) происходит автолитический распад мышечных волокон на отдельные сегменты.
Созревание мяса совершается в течение 24—72 часов при температуре +4°. Однако не всегда удастся выдерживать мясо при +4°. Иногда приходится хранить его в обычных условиях при температуре +6—8° и выше; при повышенной температуре процессы посмертного окоченения и разрешения мышц протекают быстрее. Скорость созревания мяса зависит также от вида и состояния здоровья убитого животного, его упитанности и возраста; но эти вопросы требуют дальнейшего наблюдения и изучения.
При созревании мяса происходит расщепление некоторых нуклеидов (азотистых экстрактивных веществ). Образуются летучие вещества, эфиры и альдегиды, придающие аромат мясу. Появляются адениловая и инозиновая кислоты, аденин, ксантин, гипоксантин, от которых и зависят вкусовые качества мяса. Меняется реакция среды мяса в сторону кислотности (рН 6,2—5,8). Это способствует набуханию коллоидов протоплазмы, благодаря чему мясо приобретает мягкость, нежность и хорошо поддается кулинарной обработке.
Мясо такого качества получается через 1—3 суток его хранения при температуре от 4 до 12° (в зависимости от возможностей предприятий).
На первом этапе этого процесса обнаруживается сегментация в отдельных мышечных волокнах при сохранении эндомизия волокон. При этом в сегментах сохраняется структура ядер, поперечная и продольная исчерченность.
На втором этапе сегментации подвергаются большинство мышечных волокон. Как и на первом этапе, эндомизий волокон, а в сегментах структура ядер, поперечная и продольная исчерченность продолжают сохраняться. Наконец, на третьем этапе (фаза глубокого автолиза) обнаруживается распад сегментов на миофибриллы, а миофибрилл на саркомеры.
Саркомеры при микроскопии срезов, сделанных из такого мяса, просматриваются в виде зернистой массы, заключенной в эндомизий.
Морфологические и микроструктурные изменения в тканях также являются причиной размягчения и разрыхления мяса в процессе его созревания, благодаря чему пищеварительные соки более свободно проникают к саркоплазме, что улучшает ее переваримость. Необходимо отметить, что соединительнотканные белки при созревании мяса почти не подвергаются протеолитическим процессам. Поэтому при равных условиях созревания нежность различных отрубов мяса одного и того же животного, а также одинаковых отрубов различных животных оказывается неодинаковой; нежность мяса, содержащего много соединительной ткани, невелика, а мясо молодых животных нежнее, чем старых.
В результате комплекса автолитических превращений различных компонентов мяса при его созревании образуются и накапливаются вещества, обусловливающие аромат и вкус созревшего мяса. Определенный вкус и аромат придают созревшему мясу азотсодержащие экстрактивные вещества — гипоксантин, креатин и креатинин, образующиеся при распаде АТФ, а также накапливающиеся свободные аминокислоты (глутаминовая кислота, аргинин, треонин, фенилаланин и др.). В образовании букета вкуса и аромата, по-видимому, участвуют пировиноградная и молочная кислоты.
Вкус и аромат зависят от накопления в созревшем мясе легкорастворимых и летучих веществ типа эфиров, альдегидов и кетонов. В дальнейшем в ряде исследований показано, что ароматические свойства созревшего мяса улучшаются по мере накопления в нем общего количества летучих редуцирующих веществ. В настоящее время при помощи газовой хроматографии и масс-спектрометрического анализа установлено, что к соединениям, обусловливающим запах вареного мяса, относятся ацетальдегид, ацетон, этилкетон, метанол, метилмеркаптан, диметилсульфид, этилмеркаптан и др.
При повышении температуры (до 30 °С), а также при длительной выдержке мяса (свыше 20—26 суток) в условиях низких плюсовых температур ферментативный процесс созревания заходит так глубоко, что в мясе заметно увеличивается количество продуктов распада белков в виде малых пептидов и свободных аминокислот. На этой стадии мясо приобретает коричневую окраску, в нем увеличивается количество аминного и аммиачного азота, происходит заметный гидролитический распад жиров, что резко снижает его товарные и пищевые качества.
Биохимические процессы, происходящие при созревании в мясе больных животных, отличаются от биохимических процессов в мясе здоровых животных. При лихорадке и переутомлении энергетический процесс в организме повышен.
Окислительные процессы в тканях усилены. Изменение углеводного обмена при болезнях и переутомлении характеризуется быстрой убылью гликогена в мускулатуре. Поэтому почти при всяком патологическом процессе в организме животного содержание гликогена в мышцах сокращается. Поскольку гликогена в мясе больных животных меньше, чем в мясе здоровых, то и количество продуктов распада гликогена (глюкозы, молочной кислоты и др.) в мясе больных животных незначительное.
Кроме того, при тяжело протекающих заболеваниях еще при жизни животного в его мускулатуре накапливаются промежуточные и конечные продукты белкового метаболизма. В этих случаях уже в первые часы после убоя животного в мясе обнаруживается повышенное количество аминного и аммиачного азота.
Незначительное накопление кислот и повышенное содержание полипептидов, аминокислот и аммиака являются причиной меньшего снижения показателя концентрации водородных ионов при созревании мяса больных животных. Этот фактор влияет на активность ферментов мяса. В большинстве случаев концентрация водородных ионов, устанавливающаяся в результате созревания мяса больных животных, более благоприятна для действия пептидаз и протеаз.
В итоге накопление в мясе больных животных экстрактивных азотистых веществ и отсутствие резкого сдвига величины рН в кислую сторону считаются условиями, благоприятными для развития микроорганизмов.
Изменения, происходящие в мясе больных животных, по-иному влияют и на характер физико-коллоидной структуры мяса. Меньшая кислотность вызывает незначительное выпадение солей кальция, что, в свою очередь, является причиной меньшего изменения степени дисперсности белков и других изменений, характерных для них при нормальном созревании мяса. Сравнительно высокий показатель рН, накопление продуктов распада белков и благоприятные условия для развития микроорганизмов предопределяют меньшую стойкость мяса больных животных при хранении. Перечисленные признаки свойственны мясу каждого тяжелобольного животного; они являются причиной известной однотипности в изменении физико-химических показателей мяса, полученного от животных, убитых с течением патологического процесса, независимо от природы заболевания. Это положение не отрицает, специфических изменений в составе мяса при отдельных заболеваниях, но дает основание говорить об общих закономерностях созревания мяса при патологии в животном организме.
Почти при всяком патологическом обмене веществ содержание гликогена в мышцах уменьшается. Поскольку в мясе больных животных гликогена меньше (по сравнению с мясом здоровых), то и количество продуктов распада его (глюкозы, молочной кислоты и др.) незначительно.
Парное мясо рекомендуется использовать для производства варёных колбас и солёных изделий из свинины. Белки парного мяса обладают наибольшей влагосвязывающей и эмульгирующей способностью, развариваемость коллагена – максимальна. Эти обстоятельства предопределяют высокий выход готовой продукции и снижение вероятности образования дефектов при тепловой обработке.
Но работа с парным мясом требует высокой оперативности в технологическом процессе и применения специфических приёмов:
быстрое замораживание путём введения твёрдой углекислоты;
обвалка парного мяса, быстрое измельчение и посол с введением 2-4% NaCl;
введение рассолов через кровеносную систему одновременно с обескровливанием при убое;
инъекцирование рассолов в отруба непосредственно после разделки туши;
применение сублимационной сушки.
Всё это имеет особое значение, так как высока доля животных, поступающих на переработку с отклонениями от обычного развития автолитических процессов. Причина – стресс при жизни.
Дата добавления: 2015-02-10; просмотров: 285819; Мы поможем в написании вашей работы!; Нарушение авторских прав |