
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Единицы концентрации
Известны и применяются различные единицы концентрации. В табл. 35 приведены только некоторые из них.
Если в определении концентрации (см. с. 277) не конкретизируется, какие величины характеризуют содержание данного компонента и всего анализируемого объекта, то при переходе к ее единицам вносится необходимая конкретизация, и тем самым, определяется размерность как самой единицы концентрации, так и концентрации как физической величины. Рассмотрим наиболее широко употребляемые единицы концентрации.
Таблица 35
| Физическая величина | Единица физической величины | ||
| Обозначение | Размерность | Наименование | Обозначение |
| Концентрация | L-3M | Массовая концентрация | gi |
| L-3N | Молярная концентрация | CM,i | |
| M-1N | Моляльность | m i | |
| б.р. [N1 N-1] | Молярная доля | x i | |
| б.р.[М1 М-1] | Массовая доля | y i | |
| 6.p.[L3]1 [L3]-1 | Объемная доля | X i |
Массовая концентрация — единица концентрации, отвечающая содержанию в 1 м3 смеси 1 кг данного компонента.
Молярнаяконцентрация — единица концентрации, отвечающая содержанию в объеме раствора, равном 1 м3, количества данного компонента, равного 1 молю.
Моляльность— единица концентрации, отвечающая содержанию в 1 кг растворителя 1 моля данного компонента.
Массовая доля компонента А:



 Масса компонента А в смеси М
Масса компонента А в смеси М
У А = —————————————————————— = ———

 Суммарная масса смеси M
Суммарная масса смеси M
Массовая доля компонента может быть выражена в процентах:
y*A=yA 100%.
Молярная доля компонента А:



 Количество компонента А в смеси (n A) N
Количество компонента А в смеси (n A) N
XA= ——————————————————————————— = --------- --- Суммарное количество компонентов смеси ( ∑ni) N ,


где п — число молей.
Молярная доля компонента А может быть выражена в процентах:
х*A = хA • 100%.
Объемная доля компонета А:
 | 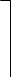 |
Объем компонента в смеси L3
XA = ----------------------------------------------------------------------- = ------------

 Суммарный объем в смеси L3
Суммарный объем в смеси L3
Объемная доля компонента А может быть выражена в процентах:
X* A = X A 100% .
В физике часто встречается единица концентрации, выраженная числом атомов в 1 см3:
Число атомов элемента А в смеси
С*= —————————————————— .
Объем смешанной фазы (см 3 )
В качестве примера рассмотрим, как можно охарактеризовать концентрации компонентов, из которых состоит ряд веществ, используя приведенные выше единицы концентрации.
Таблица 36
| Анализируемое вещество и его компоненты | Концентрация компонентов | |||
| Массовая доля, % | Молярная доля, % | Объемная доля, % | ||
| Золото (58 проба) Аu | 58,3 | 31.1 | 39,3 | |
| Сu | 41,7 | 68,9 | 60,7 | |
| Алюмо калиевые квасцы | ||||
| (К 2SO 4 * Al 2 (SO) 4) 3 * 24Н 20 | ||||
| К 2SO 4 | 18,4 | 3,8 | 10,5 | |
| Al 2 (SO 4) 3 | 36,1 | 3,8 | 20,2 | |
| Н 20 | 45,5 | 92,4 | 69,3 | |
| Дымный порох KNO 3 | 78,4 | 33,3 | 75 3 | |
| S | 11,9 | 16,7 | 12,2 | |
| С | 13,3 | 50,0 | 12,5 | |
| Спирто-водная смесь | ||||
| С 2Н 5ОН | 34,4 | 17,1 | 40,0 | |
| Н 20 | 65,6 | 82,9 | 60,0 |
Выбор единиц концентрации для данного примера произведен не случайно. В качестве единиц концентрации использованы величины, которые в НТД классифицируются как относительные величины, никоим образом с концентрацией не связанные. В действительности,
массовая, объемная и молярная доли представляют единицы концентрации. Ошибка заключается в трактовке этих величин как относительных. Подобное было отмечено и по поводу самой концентрации. Относительная величина представляет безразмерное отношение физической величины к одноименной физической величине. Однако, когда речь идет концентрации, которая выражена, например, через массовую долю, нельзя рассматривать массу всех компонентов пробы просто как физическую величину, используемую для сравнения с массой анализируемого компонента. При таком подходе не учитывается качественная особенность концентрации как физической величины.
Концентрации, выраженные в различных единицах, могут быть пересчитаны одна в другую (табл. 37). Особенность такого пересчета, по сравнению с переходом от одной единицы физической величины к другой, состоит в том, что для концентрации переходной коэффициент не является постоянным. Это обусловлено тем, что при пересчете используются индивидуальные константы, определяемые тем компонентом, концентрацию которого требуется выразить в тех или иных единицах. В частности, к ним относятся такие константы, как молекулярные массы компонентов (МA и МB для случая двухкомпонентной смеси, представленного в табл. 37), а также значения плотностей (рm ~ плотность смеси в табл. 37).
Таблица 37
| yB | xB | mB | CM, B | |
| yB | yB | MB MA ----- + MB - MA xA | -------- + 1 MBmB | MB CM , B 1000 pm |
| xB | MB(1 – yB) MA yB | xB | -------- + 1 MA mB | MA 1000 pm ---------- + MA - MB CM , B |
| mB | 1000 yB MB (1 – yB ) | 1000 xB MA (1 – xA ) | mB | pm MB -------- - --------- CM , B 1000 |
| CM , B | 1000 pm yB MB | 1000 pm MA (1 – xB ) -------------- + MB xB | pm 1 MB ---- + ------ mB 1000 | CM , B |
Изменение коэффициента при пересчете концентрации является еще одним проявлением ее специфики как именованной физической величины.
Используя различные единицы СИ для характеристики абсолютного содержания анализируемого компонента смеси и самой смеси, можно получить целый ряд единиц концентрации. Именно так получены единицы концентрации, приведенные в табл. 35. С этой целью были применены единицы массы, объема и количества вещества. Важно подчеркнуть, что все указанные в табл. 35 единицы концентрации являются единицами СИ.
Дата добавления: 2015-02-10; просмотров: 500; Мы поможем в написании вашей работы!; Нарушение авторских прав |