
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коэффициент сверхсжимаемости природных газов
Как известно, соотношение между параметрами – характеристиками состояния газа (давлением, объемом и температурой) - определяется законами газового состояния. Для идеального газа это уравнение Клапейрона - Менделеева:
 ,
,
где m - масса газа; М – его молярная масса , R – универсальная газовая постоянная, T – абсолютная температура, Р - давление, V – объем газа.
Но реальные газы не подчиняются этому закону. Для математического описания состояния реальных газов выявились два пути:
1. Первый путь Введение поправочных членов в уравнение Клапейрона - Менделеева:
* Уравнение Ван-дер-Ваальса, в котором введены две константы, учитывающие взаимодействие молекул газа и их собственный объем:
 ,
,
где V – объем газа;  - слагаемое, учитывающая силу притяжения молекул газа, b – поправка на собственный объем молекул (а=3pкрV2кр; b=Vкр /3; pкр, Vкр – критические параметры).
- слагаемое, учитывающая силу притяжения молекул газа, b – поправка на собственный объем молекул (а=3pкрV2кр; b=Vкр /3; pкр, Vкр – критические параметры).
Последнее уравнение записано для одного моля вещества. Для вещества, имеющего массу m, уравнение запишется в виде:

* Уравнение состояния Редлиха-Квонга, в котором  , т.е.
, т.е.

* Уравнение Пенга-Робинсона, включающее 3 константы:
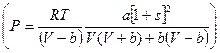
Третья константа s в этом уравнении учитывает нецентральность сил взаимодействия между сложными молекулами.
Кроме этих уравнений известны также уравнения Битти-Бриджмена с 5 константами и уравнение Бенедикта-Вебба-Рубина, в которое введены 8 констант и другие (как известно, в физике существует множество модификаций уравнения Ван-дер-Ваальса: уравнения Диттеричи, Бертло, Клаузиуса, Камерлинга-Оннеса и т.д.).
2. Второй путь – введение в уравнение коэффициента, характеризующего степень отклонения реального газа от закона идеального газа – коэффициента сверхсжимаемости газа Z:
 , где
, где 
Характер изменения функции  можно установить по изменению объема реального газа по сравнению с идеальным при прочих равных условиях с изменением температуры и давления (рис.2.1.3, 1.4).На рис.2.1.3 использовано понятие приведенных параметров – безразмерных величин, показывающих во сколько раз действительные параметры состояния газа больше или меньше критических:
можно установить по изменению объема реального газа по сравнению с идеальным при прочих равных условиях с изменением температуры и давления (рис.2.1.3, 1.4).На рис.2.1.3 использовано понятие приведенных параметров – безразмерных величин, показывающих во сколько раз действительные параметры состояния газа больше или меньше критических:
 ,
, 
В идеальных газах (по определению «силами взаимодействия между молекулами можно пренебречь») молекулы занимают незначительный объем по сравнению с объемом газа и не испытывают сил притяжения друг к другу.
В реальных газах молекулы обладают определенными размерами и массой и взаимодействуют друг с другом (поэтому реальный газ приближается к идеальному при низких давлениях, когда число молекул в единице объема мало и Z=1).
Далее рассмотрение процесса можно разделить на следующие этапы:
А). С повышением давления молекулы сближаются и вначале притягиваются, помогая внешним силам сжимать газ, т.е. реальные газы сжимаются сильнее, а Z уменьшается.
Б). Затем, когда газ сжат до такой степени, что близок по свойствам к жидкости, начинают действовать силы отталкивания и степень сжатия меньше, чем при малых давлениях, т.е. Z возрастает при дальнейшем увеличении Р.

Рис.2.1.3. Зависимость коэффициента сверхсжимаемости природного газа от приведенных абсолютных давления Рпр и температуры Тпр.

Рис.2.1.4. Зависимость коэффициента сверхсжимаемости азота от давления и температуры.
Вопросы для закрепления:
1. В каких фазовых состояниях могут находиться флюиды в земной коре?
2. На какие основные виды подразделяют продуктивные залежи в зависимости от фазового состояния и соотношения углеводородов?
3. Какие залежи относят к газоконденсатным и газогидратным?
4. Как классифицируют нефти по групповому составу?
5. В чем особенность физических свойств АСВ нефти?
6. Как зависят плотность и вязкость нефти от давления и температуры?
7. Как зависят плотность и вязкость газа от давления и температуры?
8. В чем состоят законы Дальтона и Амага для газов?
9. Как рассчитывают плотность смеси газов?
10. Что такое коэффициент сверхсжимаемости газов? Поясните его зависимость от давления и температуры.
Дата добавления: 2014-10-31; просмотров: 1134; Мы поможем в написании вашей работы!; Нарушение авторских прав |