
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Приготовление зольного раствора
Поместить 1 г золы в пробирку, смочить ее несколькими каплями дистиллированной воды, добавить 4-5 мл 25%-ного раствора соляной кислоты и выдержать на кипящей водяной бане 15-20 минут. Содержимое перенести в мерную колбу на 100 мл, затем пробирку дважды ополоснуть дистиллированной водой, сливая се в ту же колбу, довести объем до метки и тщательно перемешать.
Приготовление сока
Черешки листьев, стебли растения нарезать кусочками длиной 2-3 см, поместить в фарфоровую ступку и растереть пестиком до появления сока. Мякоть с остатками черешков сдвинуть к стенкам ступки, соку дать отстояться и взять пипеткой для анализа.
Определение серы
5 мл раствора № 1 перенести в пробирку, нагреть до кипения и прилить 3-4 мл 10%-ного раствора хлорида бария. Выпадение белого осадка сульфата бария означает, что в составе растения содержатся соединения серы.
Определение железа
3-4 мл раствора № 1 поместить в пробирку и прилить 4-5 капель 10%-ного раствора роданида калия или аммония. Появление розового окрашивания указывает на то, что в золе растений содержатся соединения железа.
Определение свинца
Многие растения содержат свинец в виде соединений, плохо переходящих в водную вытяжку. Солянокислые зольные вытяжки также не пригодны для определения свинца, так как хлорид свинца - малорастворимое соединение и в солянокислый раствор практически не переходит. Поэтому для проведения качественного анализа готовят азотнокислую вытяжку: зольный остаток 5-10 г растительной продукции растворяют в азотной кислоте, нейтрализуют раствором аммиака и проводят анализ с родизонатом натрия. Для этого 1 каплю исследуемого раствора помещают на лист фильтровальной бумаги, добавляют каплю свежеприготовленного 0,2% раствора родизоната натрия. В присутствии ионов свинца образуется синее пятно или кольцо. При добавлении 1 капли буферного раствора, содержащего в 10 мл 0,19 г гидротартрата натрия и 0,15 г винной кислоты и имеющего рН 2,8, синий цвет превращается в красный. Реакция очень чувствительна: открываемый минимум 0,1 мкг.
Основным источником загрязнения окружающей среды свинцом является автомобильный транспорт: вместе с выхлопными газами от автомобиля свинец, образующийся при сгорании этилированного бензина, попадает в атмосферу. В зависимости от интенсивности движения опасная зона вдоль автомагистралей может простираться от 10 до 500 м. В пределах этой зоны наблюдается повышенное содержание свинца в объектах окружающей cреды, например в растениях. С помощью несложных опытов можно увидеть, что количество свинца уменьшается по мере удаления от дороги. Для этого нужно собрать около 100 г растительной пробы на расстоянии 2, 10,50, 100 и т.д. м от оживленной дороги, измельчить, добавить строго определенное количество смеси этилового спирта и воды (50 мл) и кипятить или упаривать экстракт, чтобы свинец перешел в раствор. В изучаемые экстракты по каплям добавлять раствор сульфида натрия, в результате чего выпадает черный осадок сульфида свинца разной интенсивности: чем ближе к дороге, тем осадка больше.
Ионы свинца дают характерное окрашивание и со многими другими реактивами: хроматами, дихроматами, йодидами, дитизоном, n-тeтраметилдиаминодифенилметаном, которые можно применять для качественного обнаружения этого опасного загрязнителя.
Определение щелочности золы
Щелочностью золы называется число миллилитров 1н. раствора кислоты, идущей на нейтрализацию 1 г золы. Зола имеет щелочную реакцию благодаря большому содержанию углекислых солей калия и натрия.
1 г золы помещают в термостойкий стакан, приливают точно отмеренное количество титрованной 0,05 М серной кислоты и нагревают в течение 5 мин. для разложения углекислых солей. Содержимое стакана осторожно перемешивают и избыток кислоты оттитровывают 0,1 М раствором щелочи в присутствии универсального индикатора.
Расчет величины щелочности проводят по формуле:
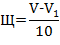
где Щ - щелочность золы, мл;
V - объем 0,05 М раствора H,S04, мл;
V1 - объем 0,1 М раствор щелочи, пошедшей на титрование избытка кислоты, мл.
Иногда щелочность выражают в мл 1 н. кислоты на 100 г взятой навески. Чем выше щелочность, тем больше в растении содержание калия, натрия, кальция.
Дата добавления: 2015-04-11; просмотров: 353; Мы поможем в написании вашей работы!; Нарушение авторских прав |