
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Й способ. Используя соотношение 22,2 л – 1 моль NH3 – 3 моль ат
Используя соотношение 22,2 л – 1 моль NH3 – 3 моль ат. N, составим пропорцию
22,4 л – 3 моль ат. N
х – 6 моль ат. N,
отсюда х = 44,8 л NH3.
Задача 5. В каком объеме сернистого газа (н.у.) содержится столько же молекул, сколько атомов натрия содержится в 7,1 г Na2SO4 ?
При решении подобных задач следует понимать, что в данном случае не требуется определять ни число атомов, ни число молекул. Из определения числа Авогадро следует, что какие бы частицы мы ни брали (молекулы, атомы, ионы, электроны и др.) число этих частиц будет одинаковым тогда, когда будут равны их количества. Поэтому фактически в таких задачах поставлен вопрос о сравнении числа молей (количества) различных частиц.
Решение.
Определим количество вещества  в 7,1 г Na2SO4.
в 7,1 г Na2SO4.
 =142 г/моль,
=142 г/моль,
отсюда
 = 7,1 г :142 г/моль = 0,05 моль атомов.
= 7,1 г :142 г/моль = 0,05 моль атомов.
В 1 моль Na2SO4 содержится 2 моль атомов Na. Определим, сколько моль атомов Na содержится в 0,05 моль Na2SO4:
1 моль Na2SO4 - 2 моль ат. Na
0,05 моль Na2SO4 - х моль ат. Na.,
отсюда х = 0,1 моль ат.Na.
По условию задачи число атомов Na должно быть равно числу молекул SO2 , а это будет в том случае, когда количества атомов Na и молекул SO2 будут одинаковыми. Отсюда следует, что количество сернистого газа равно 0,1 моль. Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, получаем
 (н.у.) = 22,4 л/моль·0,01 моль = 2,24 л.
(н.у.) = 22,4 л/моль·0,01 моль = 2,24 л.
Таким образом, в 22,4 л SO2 (н.у.) будет содержаться столько же молекул SO2, сколько атомов Na содержится в 7,1 г Na2SO4 .
Задача 6. Определить массовую долю вещества в растворе, если в 40 г раствора содержится 8 г вещества.
Решение.
1-й способ.
В соответствии с определением (I), с. 18, - массовая доля w равна
w=mв-ва/mр-ра = 8 г /40 г = 0,2; или в процентах w = 20%.
2-й способ.
На основании определения (II) составляем пропорцию
8 г в-ва - 40 г р-ра
х г в-ва - 100 г р-ра,
отсюда х = 20 г.
Это означает, согласно определению (II) с. 18 , что w = 20%.
Задача 7. В 45 мл воды растворено 5 г сульфата натрия. Определить массовую долю Na2SO4 в растворе.
Решение.
Массовая доля Na2SO4 в растворе w равна
 =
=  /mр-ра.
/mр-ра.
Масса сульфата натрия составляет 5 г. Масса раствора складывается из массы растворенного вещества (Na2SO4) и массы растворителя (воды), которая неизвестна.
Зная, что плотность воды  равна 1 г/см3, а объем воды
равна 1 г/см3, а объем воды  – 45 мл (см3), получаем
– 45 мл (см3), получаем
 =
=  ·
·  = 45 мл · 1 г/мл = 45 г
= 45 мл · 1 г/мл = 45 г
Тогда масса раствора (m р-ра) будет
mр-ра=  +
+  = 5 г+45 г = 50 г
= 5 г+45 г = 50 г
и  = 5 г/ 50 г =0,1 или 10%.
= 5 г/ 50 г =0,1 или 10%.
Задача 8. Сколько граммов раствора серной кислоты с массовой долей H2SO4 20% надо взять для полной реакции с 20 мл 10 %-ного (по массе) раствора гидроксида натрия с плотностью раствора r = 1,109 г/мл?
При решении подобных задач следует четко понимать, что: 1) поскольку вещества вступают в реакцию, то необходимо составить уравнение реакции, по которому и будет производиться основной расчет; 2) в реакции, соответствующей составленному уравнению, участвуют чистые вещества, содержащиеся в растворах, из чего следует, что в расчетах по уравнению необходимо использовать массы растворенных веществ, а не массы растворов.
Решение.
Составим уравнение реакции
2 NaOH + H2SO4= Na2SO4+2 H2O.
Определим массу NaOH, содержащуюся в 20 мл 10%-ного по массе раствора с плотностью r=1,109 г/мл.
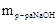 =Vр-ра · r р-ра = 20 мл · 1,109 г/мл=22,18 г,
=Vр-ра · r р-ра = 20 мл · 1,109 г/мл=22,18 г,
а в растворе NaOH содержится 10% NaOH, отсюда
 = mр-ра · w = 22,18 г · 0,1 = 2,218 г.
= mр-ра · w = 22,18 г · 0,1 = 2,218 г.
По уравнению реакции определим массу серной кислоты, участвующей в реакции, зная, что
 = 40 г/моль, а
= 40 г/моль, а  =98 г/моль
=98 г/моль
и что, согласно уравнению, один моль серной кислоты реагирует с 2 моль гидроксида натрия. Составим пропорцию
98 г H2SO4 - 2 · 40 г NaOH
х г H2SO4 - 2,218 г NaOH,
отсюда х = 27,17 г.
Таким образом, в 20% - ном (по массе) растворе H2SO4 содержится 27,17 г H2SO4. Зная массовую долю серной кислоты в растворе (w H2SO4), определим массу раствора H2SO4
 =
=  /w= 27,17 г/ 0,2 =135,85 г.
/w= 27,17 г/ 0,2 =135,85 г.
Задача 9. Сколько литров углекислого газа (н.у.) образуется при взаимодействии 50 мл 8%-ного (по массе) раствора соляной кислоты (r р-ра HСl= 1,04 г/см3) с избытком раствора карбоната калия?
Решая подобные задачи, необходимо помнить, что объем 22,4 л для определения числа молей можно использовать только применительно к объему газа, так как 22,4 л/моль - это объем 1моль газа или пара (при н.у.). Применять же эту величину (22,4 л/моль) к расчетам, непосредственно связанным с объемом растворов, нельзя.
Решение.
Составим уравнение реакции
2HCl +К2CO3= 2КCl + CO2 +H2O
mр-ра HCl= V р-ра HCl · rр-ра=50 мл · 1,04 г/мл=52 г
mHСl = m р-ра HCl · w HСl = 52 г · 0,08 = 4,16 г.
Из уравнения реакции следует, что при взаимодействии 2 моль HCl с К2CO3 образуется 1 моль СО2 (н.у.) . Учитывая, что МHСl =36,5 г/моль, а 1 моль СО2 (н.у.) занимает объем 22,4 л, составим пропорцию
2 · 36,5 г HCl – 22,4 л СО2
4,16 г HCl – х л СО2,
отсюда х=1,26 л, т.е.  (н.у.) = 1,26 л.
(н.у.) = 1,26 л.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ
I. Теоретические вопросы.
1. Дайте определение понятий: атом, молекула, химический элемент.
2. Что называется простым веществом? Газ хлор – простое или сложное вещество?
3. Что называется атомной единицей массы? Как определить молекулярную массу вещества? Поясните на примере серной кислоты.
4. Дайте определение понятий: моль, число Авогадро. Что означает выражение «моль атомов»?
5. Сформулируйте закон постоянства состава вещества. Проиллюстрируйте его на примере.
6. Что называется молярной массой вещества? Как рассчитать число молей вещества, если известны масса вещества и его молярная масса?
7. Дайте определение закона Авогадро. Одинаковое ли количество вещества будет содержаться в равных объемах различных газов, взятых при одних и тех же условиях (давлении и температуре)?
8. Какой объем занимает 1 моль газа при нормальных условиях? Что такое нормальные условия? Как определить количество газа, если известен его объем при нормальных условиях?
9. Как определить количество вещества, если известно число молекул, содержащихся в нем?
10. Назовите классы неорганических соединений и приведите примеры.
11. Что такое оксиды? Какие типы оксидов существуют? Приведите примеры.
12. Что такое кислоты? Приведите примеры одно-, двух- и трехосновных кислот. Как определить заряд аниона – кислотного остатка?
13. Что такое основания? Чем определяется число гидроксильных групп в формуле основания? Какие основания растворяются в воде?
14. Какая реакция называется реакцией нейтрализации? Приведите примеры.
15. Что такое средние, кислые и основные соли? Приведите по одному примеру и назовите соли.
II. Назовите следующие соединения. К каким классам неорганических соединений они относятся?
| 16. | P2O 5 | Al(OH)3 | H3PO4 | CuCl2 | KHSO3 |
| 17. | CaO | Fe(OH)3 | HNO3 | Zn(NO3)2 | Pb(HSO4)2 |
| 18. | N2O5 | Cu(OH)2 | H2CO3 | NH4NO2 | Ca(H2PO4)2 |
| 19. | Al2O3 | Mg(OH)2 | HF | Cr2(SO4)3 | FeOH(NO3)2 |
| 20. | Na2O | Pb(OH)2 | HNO2 | K2SO3 | MgOHCl |
| 21. | MnO | Fe(OH)2 | H2SO3 | AgCl | Mg(HCO3)2 |
| 22. | ZnO | KOH | H2S | Na2SiO3 | (CuOH)2CO3 |
| 23. | Fe2O3 | Ba(OH)2 | H2SiO3 | ZnS | CaHPO4 |
III. Укажите степени окисления атомов всех элементов в формулах следующих соединений:
| 24. | Al2O3 | K2SO4 | Fe(NO3)3 | KMnO4 |
| 25. | N2O5 | Ca3(PO4)2 | NaHSO3 | K2MnO4 |
| 26. | MnO2 | Mg(NO3)2 | K2SO4 | CaHPO4 |
| 27. | Fe2O3 | H2CrO4 | FeOHCl2 | Na2SO3 |
| 28. | P2O 5 | Fe2(SO4)3 | K2Cr2O7 | MgOHCl |
| 29. | Mg3N2 | HClO4 | PbSO4 | NaHS |
| 30. | Al4C3 | NaNO2 | KClO3 | CaOHNO3 |
| 31. | Cr2S3 | NH4Cl | Na2B4O7 | KClO4 |
IV. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
32. Фосфор ® оксид фосфора (V) ® ортофосфорная кислота ® ортофосфат натрия ® ортофосфат кальция.
33. Натрий ® оксид натрия ® гидроксид натрия ® сульфат натрия ® сульфат бария.
34. Сера ® оксид серы (IV) ® сернистая кислота ® сульфит натрия ® гидросульфит натрия.
35. Железо ® хлорид железа (II) ® гидроксид железа (II) ® оксид железа (II) ®сульфат железа (II).
36. Углерод ® оксид углерода (IV) ® карбонат калия ® гидрокарбонат калия ® карбонат калия.
37. Железо ® хлорид железа (III) ® гидроксид железа (III) ® оксид железа (III) ® нитрат железа (III).
38. Цинк ® сульфат цинка ® гидроксид цинка ® нитрат цинка ® сульфид цинка.
39. Магний ® хлорид магния ® гидроксид магния ® сульфат магния ® фосфат магния.
V. Задачи.
40. Сколько молей атомов азота содержится в 0,4 г нитрата аммония (NH4NO3)? Какова масса этого количества азота?
41. Сколько граммов кислорода содержится в 2 моль азотной кислоты?
42. Определите количество фосфора, содержащегося в 8,75 г фосфата кальция?
43. В каком объеме хлора (нормальные условия) содержится столько же молекул, сколько их содержится в 49 г серной кислоты?
44. Сколько моль газов содержится в смеси, состоящей из 6,72 л азота и 5,6 л оксида углерода (IV)? Объемы газов измерены при нормальных условиях.
45. Масса 200 мл газа (нормальные условия) равна 0,232 г. Определите молярную массу этого газа.
46. Какой объем при нормальных условиях занимают 27 · 1021 молекул газа?
47. Где содержится больше атомов водорода: в двух литрах метана или в двух литрах водорода? Объемы газов измерены при нормальных условиях.
48. К 250 мл раствора соляной кислоты с массовой долей HCl 10% (плотность раствора 1,05 г/см3) добавили избыток раствора карбоната натрия. Какой объем оксида углерода (IV) (нормальные условия) может образоваться в результате реакции?
49. Сколько мл раствора соляной кислоты с массовой долей HCl 15% (плотность раствора 1,075 г/см3) потребуется для полного растворения 8,1 г алюминия?
50. Сколько литров водорода, измеренных при нормальных условиях, выделится при взаимодействии избытка цинка с 200 мл раствора соляной кислоты с массовой долей HCl 10% (плотность раствора 1,05 г/см3) ?
51. При взаимодействии 16 г раствора серной кислоты с избытком хлорида бария выделился осадок массой 5,7 г. Определите массовую долю серной кислоты в исходном растворе.
52. Сколько граммов раствора с массовой долей гидроксида калия 4% потребуется для полной нейтрализации 50 г раствора серной кислоты с массовой долей H2SO4 5%?
53. Для нейтрализации 200 г раствора азотной кислоты было израсходовано 150 мл 10%-ного по массе раствора гидроксида калия (плотность раствора 1,09 г/см3). Вычислите массовую долю азотной кислоты в растворе.
54. Сколько литров диоксида углерода (нормальные условия) нужно пропустить через 200 мл раствора гидроксида натрия с массовой долей NaOH 10% (плотность раствора 1,109 г/см3) для получения гидрокарбоната натрия?
55. Через 240 г раствора сульфата меди пропустили 16,8 л (н.у.) газа сероводорода для полного осаждения сульфида меди(II). Определите массовую долю CuSO4 в исходном растворе.
Домашние задания
| Вариант | |||||||||||||||
| Номера вопросов | |||||||||||||||
Дата добавления: 2015-04-11; просмотров: 587; Мы поможем в написании вашей работы!; Нарушение авторских прав |