
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОКСИДЫ.
Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2 .
| Формула | Название | Формула | Название |
| CO | оксид углерода ( II ) | Fe2O3 | оксид железа (III ) |
| NO | оксид азота ( II ) | CrO3 | оксид хрома (VI ) |
| N2O5 | оксид азота (V ) | Mn2O7 | оксид марганца (VII ) |
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом | простых веществ | 2Mg +O2=2MgO |
| сложных веществ | 2H2S+3O2=2H2O+2SO2 | |
| Разложение | нагреванием солей | СaCO3=CaO+CO2 
|
| нагреванием оснований | Cu (OH)2=CuO+H2O | |
| нагреванием кислородсодержащих кислот | H2SO3=H2O+SO2 
| |
| нагреванием высших оксидов | 4CrO3=Cr2O3+3O2 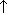
| |
| Окисление низших оксидов | 4FeO+O2=2Fe2O3 | |
| Вытеснение летучего оксида менее летучим | Na2CO3+SiO2=Na2SiO3+CO2 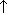
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.

| ||
| Основные-реагируют с избытком кислоты с образованием соли и воды.Основным оксидам соответствуют основания. 1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.) CaO+H2O=Ca(OH)2 2.Все-с кислотами МgO+2HCl=MgCl2+H2O 3.С кислотнями оксидами CaO+CO2=CaCO3 4.С амфотерными оксидами Li2O+Al2O3=2LiAlO2 | Амфотерные (ZnO, Al2O3,Cr2O3, MnO2 ) 1.Взаимодействуют как с кислотами, так и с основаниями. ZnO+2HCl=ZnCl2+H2O ZnO+2NaOH+H2O=Na2[Zn(OH)4] 2.Реагируют с основными и кислотными оксидами ZnO+CaO=CaZnO2 ZnO+SiO2=ZnSiO3 | Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты. 1.Большинство взаимодействуют с водой SO3+H2O=H2SO4 2.Со щелочами NaOH+SiO2=Na2SiO3+H2O 3.С основными оксидами SiO2+CaO=CaSiO3 4.С амфотерными оксидами Al2O3+3SO3=Al2(SO4)3 |
10 Гидроксиды (определение, название, кислотность, растворимые, нерастворимые, основные, кислотные, амфотерные).
Гидроксиды - продукты соединения оксидов с водой. Они бывают трех видов: основные (основания), кислотные (кислоты) и амфотерные (амфолиты). Основания – электролиты, которые при диссоциации в качестве анионов образуют только гидроксид-ионы: NaOH = Na+ + OH-. Поэтому с точки зрения электролитической диссоциации общие свойства оснований обусловлены гидроксид-ионами OH-. Кислотность основания определяется числом ионов OH-, образующихся при диссоциации. Многокислотные основания диссоциируют ступенчато: Mg(OH)2 ⇄ (MgOH)+ + OH-, (MgOH)+ ⇄ Mg2+ + OH-.
По растворимости в воде различают два вида основания: а) основания, растворимые в воде. К ним относятся LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, а также TlOH; NaOH и KOH называют щёлочами; б) основания, нерастворимые в воде, например Cu(OH)2, Fe(OH)3, Cr(OH)3 и др. Названия оснований образуются из слова гидроксид и названия соответствующего металла с указанием его степени окисления, если она переменна. Например, Ca(OH)2 - гидроксид кальция, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III). Водные растворы оснований изменяют окраску индикаторов. В их присутствии лакмусовая бумага окрашивается в синий цвет, фенолфталеин становится малиновым, метиловый оранжевый – жёлтым. Основания образуют с кислотными оксидами соль и воду:
Ba(OH)2 + CO2 = BaCO3 + H2O.
Основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации): 2 NaOH + H2SO4 = Na2SO4 + 2 H2O. При действии оснований на растворы солей получаются новые соль и основание, при этом одно из полученных веществ должно выпадать в осадок: 2 KOH + CuSO4 = Cu(OH)2↓ + K2SO4; Ca(OH)2 + Na2CO3 = CaCO3↓ + 2 NaOH.
Нерастворимые в воде основания, так же как и растворимые, взаимодействуют с кислотами: Fe(OH)3 + 3 HCl = FeCl3 + 3 H2O и разлагаются при нагревании: t 2 Fe(OH)3 = Fe2O3 + 3 H2O. Основания получают растворением в воде соответствующих оксидов: CaO + H2O = Ca(OH)2
или разложением воды очень активными металлами (K, Na, Ca, Ba): 2 Na + 2 HOH = 2 NaOH + H2
Общий способ получения нерастворимых в воде оснований – действие щёлочей на растворимые соли металлов, основания которых нерастворимы: 2 NaOH + FeSO4 = Fe(OH)2↓ + Na2SO4.
Кислоты – электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н+ (точнее ионы гидроксония Н3О+): HCl = H+ + Cl-.
Поэтому с точки зрения электролитической диссоциации общие свойства кислот обусловлены ионами водорода Н+. Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации. Многоосновные кислоты диссоциируют ступенчато. Например: H2CO3 ⇄ H+ + НCО3-, НCО3- ⇄ H+ + CО32-. Кислоты можно разделить на бескислородные (HCl, HBr, HCN, H2S) и кислородсодержащие (HNO3, H2SO4, H3PO4). В названиях бескислородных кислот к наименованию элемента добавляют слово водородная. Например, HCl - хлороводородная, H2S - сероводородная.
Названия кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента. Максимальной степени окисления элемента соответствует суффикс –н или -ов (-ев) и окончание –ая. Например, HN+5O3 - азот-н-ая кислота, H2S+6O3 – серная кислота, HCl+7O4 - хлорная кислота, H3As+5O4 - мышьяковая кислота, H2Si+4O3 - кремниевая кислота. По мере понижения степени окисления центрального атома суффиксы изменяются в следующей последовательности: -оват-, -ист-, -оватист-. Например, HCl+5O3 - хлорн-оват-ая, HCl+3O2 - хлористая, HCl+1O - хлорноватистая кислоты. Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс –ист; например HN+3O2 – азотистая кислота. Если элемент, находясь в одной и той же степени окисления, образует несколько кислот, содержащих по одному атому данного элемента в молекуле (например, HPO3 и H3PO4), то название кислоты, содержащей наименьшее число атомов кислорода, снабжается приставкой мета-, а название кислоты с наибольшим числом атомов кислорода - приставкой орто- (HPO3 - метафосфорная кислота, H3PO4 - ортофосфорная кислота). Если молекула кислоты содержит два атома кислотообразующего элемента, то перед её названием помещается числительная приставка дву- или ди-, например: H4P2O7 - двуфосфорная кислота, H2S2O7 – двусерная кислота.
В растворах кислот некоторые индикаторы меняют свою окраску: лакмус становится красным, метиловый оранжевый – розовым.
Кислоты взаимодействуют с металлами, стоящими левее водорода в ряду стандартных электродных потенциалов, образуя соль и водород: Са + H2SO4 = СаSO4 + H2. Водород не выделяется при взаимодействии металлов с концентрированными азотной и серной кислотами, а также разбавленной азотной кислотой.
Кислоты реагируют с основаниями и основными оксидами: H2SO4 + Mg(OH)2 = MgSO4 + 2 H2O, 2 HNO3 + CaO = Ca(NO3)2 + H2O.
При взаимодействии кислот с солями образуются новые соль и кислота:
 CO2
CO2
 2 HCl + CaCO3 = CaCl2 + H2CO3
2 HCl + CaCO3 = CaCl2 + H2CO3
H2SO4 + BaCl2 = BaSO4↓ + 2 HCl.
Кислоты получают следующими способами: 1) гидратацией кислотных оксидов P2O5 + 3 H2O = 2 H3PO4; 2)обменной реакцией соли с кислотой CaСl2 + H2SO4 = CaSO4 + 2 HCl.
Амфолиты – это гидроксиды, которые проявляют как основные, так и кислотные свойства. К ним относятся, например, Cr(OH)3, Zn(OH)2, Be(OH)2, Al(OH)3 и др. Амфотерные гидроксиды способны реагировать как с кислотами, так и с щёлочами. С кислотами они реагируют как основания, а с щёлочами – как кислоты. Чтобы установить амфотерность гидроксида, следует провести две реакции взаимодействия его с кислотой и со щелочью. Если обе реакции имеют место, то гидроксид амфотерный. Например,
Cr(OH)3 + 3 HCl = CrCl3 + 3 H2O; Cr(OH)3 + 3 NaOH (разб.) = Na3[Cr(OH)6]; Cr(OH)3 + NaOH (конц.) = NaCrO2 + 2 H2O.
Гидроксиды образованы атомами некоторого элемента (кроме фтора и кислорода) и гидроксогруппами OH-:
Э(OH)n (n = 1 - 6)
При n > 2 существуют орто- и мета-формы гидроксидов:
|
Орто-гидроксиды переходят в мета-форму при отщеплении молекул воды.
Дата добавления: 2015-04-15; просмотров: 244; Мы поможем в написании вашей работы!; Нарушение авторских прав |