
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГИДРОЛИЗ СОЛЕЙ.
⇐ ПредыдущаяСтр 3 из 3
| Гидролиз солей- взаимодейтсвие солей с водой, приводящее к присоединению протона Н+ молекулы воды к аниону кислотного остатка или гидроксогруппы ОН- к катиону металла. Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям, или анионами, соответствующими слабым кислотам. |
| Соль образована слабым основанием и сильной кислотой | Соль образована сильным основанием и слабой кислотойкислотой |
CuCl2=Cu2++2Cl- H2O 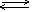 H++OH- Cu2++H2O H++OH- Cu2++H2O 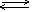 CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O CuOH++H+ Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O 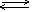 CuOHCl+HCl CuOHCl+HCl
|
Na2CO3=2Na++CO32- H2O 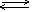 H++OH- CO32-+H2O H++OH- CO32-+H2O 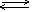 HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O HCO3-+OH- Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O 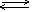 NaHCO3+NaOH NaHCO3+NaOH
|
| Соль образована слабой кислотой и слабым основанием | |
(NH4)S=2NH4++S2- NH4++H2O 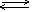 NH3· H2O+H+ S2-+H2O NH3· H2O+H+ S2-+H2O 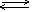 HS-+OH- Образуется слабодиссоциированный анион HS-и растворенный в воде аммиак. HS-+OH- Образуется слабодиссоциированный анион HS-и растворенный в воде аммиак.
| Al2S3+6H2O=2Al(OH)3 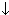 +3H2S +3H2S 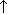 Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S Данная реакция гидролиза необратима, т.к. образуется осадок Al(OH)3 и выделяется сероводород H2S
|
| Гидролиз усиливается |
| а) при нагревании раствора ( гидролиз обычно эндотермический процесс ) б) при разбавлении раствора водой |
13 Эквивалент, эквивалентная масса, закон эквивалентов.(закон авагадро)
телефон
14 Эквивалент и эквивалентные массы простых и сложных веществ.
Дата добавления: 2015-04-15; просмотров: 252; Мы поможем в написании вашей работы!; Нарушение авторских прав |