
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислотные и основные оксиды
При полной дегидратации гидроксидов всегда получаются оксиды:
H2SO4 = SO3 + H2O
2LiOH = Li2O + H2O
H2CO3 =CO2 + H2O
Ca(OH)2 = CaO + H2O
Кислотным гидроксидам (кислородным кислотам) H2SO4 и H2CO3 отвечают кислотные оксиды, оснóвным гидроксидам LiOH и Ca(OH)2 - оснóвные оксиды. Степени окисления элементов в гидроксиде и соответствующем ему оксиде одинаковы.
Названия оксидов:
SO3 - триоксид серы
CO2 - диоксид углерода
N2O5 - пентаоксид диазота
Li2O - оксид лития
CaO - оксид кальция
FeO - оксид железа(II) Кислотные и осн&3243;вные оксиды сохраняют солеобразующие свойства соответствующих гидроксидов при взаимодействии с противоположными по свойствам гидроксидами или между собой:
N2O5 + 2NaOH = 2NaNO3 + H2O
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H2O
Li2O + SO3 = Li2SO4 Некоторые (но далеко не все) реагируют с водой, переходя в гидроксиды:
Cl2O7 + H2O = 2HClO4
P2O5 + 3H2O = 2H3PO4
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2 Оснóвные и кислотные оксиды можно получить при сжигании металлов и неметаллов в кислороде или на воздухе:
4Li + O2 = 2Li2O
2Mg + O2 = 2MgO
S + O2 = SO2
4P + 5O2 = 2P2O5
11 Кислоты (определение, название, основность, кислородсодержащие, бескислородные).
Кислоты-сложные вещества, состоящие из одного или нескольких атомов водорода, способных
заместиться на атом металла, и кислотного остатка.Число атомов кислорода определяет основность кислот.
| Бескислородные | Кислородсодержащие |
| HCl, HBr, HI, H2S анион "-ид" HCl-хлороводородная(соляная кислота), Cl--хлорид H2S-сероводородная, S2- | H2SO4, HNO3, H2CO3, H3PO4 и другие. |
ПОЛУЧЕНИЕ.
| Кислородсодержащие | 1.Кислотный оксид+вода | SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4 |
| 2.Металл+сильный окислитель | P+5HNO3+2H2O=3H3PO4+5NO | |
| 3.Cоль+менее летучая кислота | NaNO3+H2SO4=HNO3  +NaHSO4 +NaHSO4
| |
| Бескислородные | 1.Водород+неметалл | H2+Cl2=2HCl |
| 2.Cоль+менее летучая кислота | NaCl+H2SO4=2HCl  +NaHSO4 +NaHSO4
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ

| |
| 1.Изменяют окраску индикаторов | |
| лакмус-красный, метилоранж-красный ( только для растворимых кислот) | |
| 2.Взаимодействие с металлами, стоящими до водорода | |
H2SO4+Ca=CaSO4+H2 
| 2HCl+Ca=CaCl2+H2 
|
| 2.Взаимодействие с основными оксидами | |
| H2SO4+CaO=CaSO4+H2O | 2HCl+CaO=CaCl2+H2O |
| 3.Взаимодействие с основаниями | |
| H2SO4+Ca(OH)2=CaSO4+2H2O | 2HCl+Ca(OH)2=CaCl2+2H2O |
| 4.Взаимодействие с амфотерными оксидами | |
| H2SO4+ZnO=ZnSO4+H2O | 2HCl+ZnO=ZnCl2+H2O |
| 5.Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |
| H2SO4+BaCl2=BaSO4+2HCl | 2HCl+Na2CO3=2NaCl+H2O+CO2 
|
| 6.При нагревании | |
| Слабые кислоты легко разлагаются H2SiO3=H2O+SiO2 | H2S=H2+S |
| Физические свойства кислот | ||
| Жидкости H2SO4 HClO4 и др. | Твердые H3PO4 H2SiO3 и др. | Газообразные HCl H2S и др. |
| СХЕМА ВЗАИМОДЕЙСТВИЯ АЗОТНОЙ КИСЛОТЫ С МЕТАЛЛАМИ РАЗНОЙ АКТИВНОСТИ |
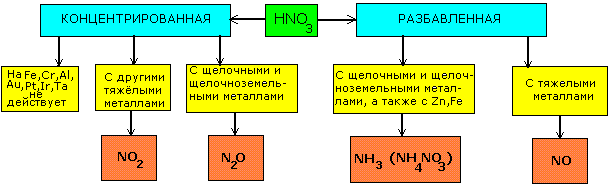
|
12 Соли (средние, кислые, основные). Название солей.
Соли-сложные вещества, состоящие из атома металла, или иона аммония NH+4 и кислотного остатка (иногда содержат водород).
| КЛАССИФИКАЦИЯ СОЛЕЙ | |

|
НАЗВАНИЯ НЕКОТОРЫХ СОЛЕЙ.
| Кислотный остаток (анион) | Название соли |
| Cl- | хлорид |
| F- | фторид |
| NO3- | нитрат |
| NO2- | нитрит |
| S2- | сульфид |
| SO32- | сульфит |
| SO42- | сульфат |
| CO32- | карбонат |
| SiO32- | силикат |
| PO43- | фосфат |
| CN- | цианид |
| NCS- | тиоционат |
| ClO- | гипохлорит |
| ClO2- | хлорит |
| ClO3- | хлорат |
| ClO4- | перхлорат |
ПОЛУЧЕНИЕ.
| 1.С использованием металлов | металл+неметалл | Mg+Cl2=MgCl2 |
| металл+кислота | Zn+2HCl=ZnCI2+H2 
| |
| металл+соль | Fe+CuSO4=FeSO4+Cu | |
| 2.С использованием оксидов | основной оксид+кислота | CaO+2HCl=CaCl2+H2O |
| кислотный оксид+основание | CO2+Ca(OH)2=CaCO3+H2O | |
| кислотный+основной оксиды | CaO+CO2=CaCO3 | |
| основной+амфотерный оксиды | Al2O3+CaO=Ca(AlO2)2 | |
| 3.Реакция нейтрализации | кислота+основание | H2SO4+2NaOH=Na2SO4+2H2O |
| 4.Из солей | соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3
|
| соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4
| |
| соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
| |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях(при избытке кислоты) | ||
| NaOH+H2SO4=NaHSO4+H2O | ||
| Основные соли образуются при взаимодействии некоторых солей со щелочами (при избытке щелочи) | ||
ZnCl2+NaOH=ZnOHCl  +NaCl +NaCl
|
ФИЗИЧЕСКИЕ СВОЙСТВА.
| Соли-твердые кристаллические вещества. Многие вещества имеют высокие температуры плавления и кипения. По растворимости делятся на растворимые и нерастворимые. |
ХИМИЧЕСКИЕ СВОЙСТВА.
| Разложение при прокаливании | CaCO3=CaO+CO2 
|
| Cоль+металл | Fe+CuSO4=FeSO4+Cu |
| Соль+соль | AgNO3+NaCl=AgCl  +NaNO3 +NaNO3
|
| Соль+щелочь | CuSO4+2NaOH=Cu(OH)2  +Na2SO4 +Na2SO4
|
| Соль+кислота | Na2CO3+2HCl=2NaCl+H2O+CO2 
|
Дата добавления: 2015-04-15; просмотров: 292; Мы поможем в написании вашей работы!; Нарушение авторских прав |