
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
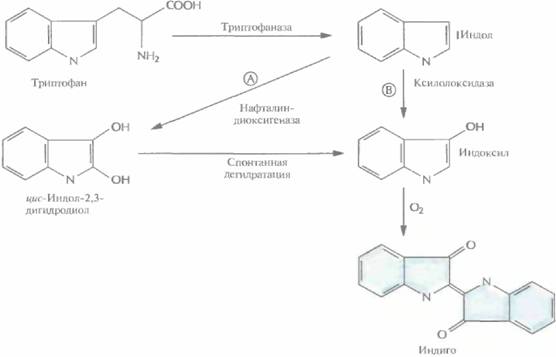
ГЛАВА 12. 1. Превращение триптофана в индол с помощью триптофаназы, которая синтезируется в хозяйских клетках Е
1. Превращение триптофана в индол с помощью триптофаназы, которая синтезируется в хозяйских клетках Е. coli.
2. Окисление индола до цис-индол-2,3-дигидродиола под действием нафталин-диоксигеназы, которая кодируется ДНК, переклонированной из плазмиды NAH7.
3. Спонтанная дегидратация.
4. Окисление на воздухе с образованием индиго.
Таким образом, комбинация ферментов двух разных метаболических путей двух разных организмов привела к неожиданному синтезу красителя индиго. Введение в Е. coli гена ксилолоксидазы, содержащегося в плазмиде TOL, может обеспечить превращение триптофана в индоксил, спонтанно окисляющийся до индиго (рис. 12.6).
Индиго, синий пигмент, который применяется для окрашивания хлопка и шерсти, был впервые выделен из растений; сейчас его получают путем химического синтеза. По оценкам, в год производится примерно 1,5·107 кг этого красителя на сумму около 200 млн. долл. Индиго окрашивают джинсовую ткань, и объем его продаж больше, чем любого другого красителя. Возможность получения индиго с помощью микроорганизмов позволяет разработать весьма эффективный и экономичный крупномасштабный микробиологический способ его производства, что дает возможность обойтись без использования таких токсичных веществ, как анилин, формальдегид и цианид, которые необходимы при химическом синтезе индиго. В настоящее время биотехнологи пытаются подобрать оптимальные условия выращивания больших количеств штамма Е. coli, способного к синтезу индиго. Среди подбираемых параметров температура, pH и количество триптофана в среде, обеспечивающее максимальный выход
|
| Рис. 12.6. Биосинтез индиго из триптофана, осуществляемый генетически модифицированной Е, coli. Триптофаназа - один из ферментов, продуцируемых E. coli. Ген нафталиндиоксигеназы, катализирующей реакцию А, происходит из плазмиды NAH, а ген ксилолоксидазы, катализирующей реакцию Б, — из плазмиды TOL. В трансформированных клетках E. coli индиго синтезируется либо по пути А, либо по пути Б, но не по ним обоим одновременно. |
Использование рекомбинантныхмикроорганизмов для получения коммерческих продуктов 255

|
| Рис. 12.7. Схематичное изображение биореактора, в котором можно было бы осуществлять синтез индиго с использованием рекомбинантных клеток Е. coli. Клетки иммобилизованы на частицах твердого матрикса. В реактор непрерывно подается субстрат (триптофан) и непрерывно выводится продукт (индиго). Скорость переноса вещества через реактор лимитируется скоростью превращения субстрата в продукт. |
продукта. Эта система еще не готова для коммерческого использования, но уже ясно, что микробиологический процесс мог бы проходить в биореакторе, в котором рекомбинантные E. coli химически иммобилизованы на твердой матрице (например, на целлюлозе или силикагеле). Реактор мог бы работать в непрерывном режиме, с поступлением триптофана с одной его стороны и удалением индиго с другой (рис. 12.7).
Синтез аминокислот
Аминокислоты широко применяются в пищевой промышленности — в качестве усилителей вкуса и аромата, антиоксидантов и пищевых добавок; в сельском хозяйстве — в качестве кормовых добавок; в медицине — для терапии послеоперационных больных; в химической промышленности -в качестве исходных веществ при синтезе полимеров и производстве косметических средств (табл. 12.1). По оценкам, ежегодно в мире производится более 800 000 т аминокислот стоимостью более 5 млрд. долларов. При этом больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которая используется для получения широко известного усилителя вкуса и аромата – глутамата натрия.
В промышленном масштабе аминокислоты получают в основном либо экстракцией из белковых гидролизатов, либо как продукты метаболизма двух неспорулирующих грамположительных почвенных бактерий, Corynebacterium или Brevibacterium spp. Обычно для повышения продуктивности этих микроорганизмов используется мутагенез с последующим отбором штаммов — сверхпродуцентов определенных аминокислот. Однако такой способ получения штаммов требует много времени, а эффективность его невелика. Альтернативный подход мог бы состоять в выделении и изменении специфических генов, кодирующих ключевые ферменты определенных биохимических реакций, на основании детальных биохимических данных об этих ферментах. Впрочем, такой генноинженерный подход может оказаться не столь простым. Так, в биосинтезе некоторых аминокислот могут участвовать несколько ферментов, которые активируются или ингибируются различными метаболитами, присутствующими в клетке. В такой ситуации трудно определить, какой фермент нужно модифицировать, чтобы увеличить выход конечного продукта. Кроме того, ученые пока не располагают исчерпывающими данными о биохимических свойствах указанных выше микроорганизмов, а соответствующие генноинженерные подходы находятся на стадии разработки. В частности, только создаются экспрессирующие векторы и методики трансформации для грамположительных организмов типа Corynebacterium и Brevibacterium spp.
Большинство плазмидных векторов с широким кругом хозяев реплицируются только в грамотрицательных микроорганизмах, поэтому необходимо создать векторы, специально предназначенные для экспрессии в Corynebacîenum и Brevibacterium spp. Это могли бы быть челночные векторы Е. coli—Corynebacterium. Ta их часть, которая происходит из плазмид E. coli, может со-
Дата добавления: 2015-04-16; просмотров: 386; Мы поможем в написании вашей работы!; Нарушение авторских прав |