
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 12. Меланины -- это нерегулярные полимеры, состоящие из остатков индола, бензотиазола и аминокислот
Меланины -- это нерегулярные полимеры, состоящие из остатков индола, бензотиазола и аминокислот. Первый этап их биосинтеза катализируется медьсодержащим ферментом моно-оксигеназой тирозиназы и представляет собой окисление тирозина до дигидроксифенилаланинхинона. Последние этапы полимеризации не являются каталитическими реакциями и в зависимости от химической природы нехинонных соединений, включающихся в полимерную структуру, дают конечные продукты разных цветов: черного, коричневого, желтого, красного или фиолетового.
Выделены и охарактеризованы гены биосинтеза меланина в бактериальных клетках Streplomyces antibioticus. Они содержат две открытые рамки считывания (ORF), одна из которых кодирует тирозиназу (мол. масса 30 600), а вторая (ORF438) — белок (мол, масса примерно 14 800) с неизвестными функциями. Чтобы проверить, нужны ли оба этих гена для синтеза меланина, гены сначала переклонировали в экспрессирующий вектор Е. соli, при этом одна конструкция содержала только ген тирозиназы, а другая — и ген тирозиназы, и ORF438 (рис. 12.19). Вектор, несущий ген тирозиназы, обеспечивал синтез больших количеств тирозиназы, чем вектор, содержащий оба указанных гена. Однако оказалось, что уровень тирозиназы не имеет особого значения, а для биосинтеза меланина необходимы продукты обоих генов. Возможно, белок, кодируемый ORF438, поставляет ионы меди неактивному предшественнику тирозиназы апотирозиназе, которая активируется в их присутствии. В естественных условиях после образования дигидроксифенилаланинхинона при участии тирозиназы в полимер включаются различные низкомолекулярные соединения (нехиноны). С учетом этого можно изменять химические и физические свойства меланина, синтезируемого в клетках E. coli с введенными в них ключевыми генами биосинтеза этого полимера, если добавлять в среду определенные низкомолекулярные соединения в разных количествах.
Микробиологический синтез животного биополимера с адгезивными свойствами
Весьма перспективной представляется также разработка недорогого способа получения белка с адгезивными свойствами, впервые выделенного из мидий Mytilus edulis. Этот водостойкий белок образует очень прочные нити, с помощью которых моллюски прикрепляются к разнообразным поверхностям. Сразу после секреции биополимера так называемой биссаловой железой между полимерными цепями образуются многочисленные поперечные сшивки, что затрудняет определение их аминокислотной последовательности. Это в свою очередь не позволяет установить нуклеотидную последовательность кодирующих их генов и синтезировать гибридизационные зонды. К счастью, удалось выделить внутриклеточный предшественник адгезивного белка (130 кДа-предшественник). Как показали биохимические исследования, он богат серином, треонином, лизином, пролином и тирозином. От 60 до 70% этих аминокислот содержат гидроксильную группу, при этом большинство остатков пролина и тирозина гидроксилированы до 3- или 4-гидроксипролина (Hyp) и 3,4-дигидроксифенилаланина (DOPA) соответственно. Кроме того, после определения аминокислотной последовательности выяснилось, что предшественник состоит в основном из повторяющихся декапепти-

| Рис. 12.19. Экспрессирующие плазмиды E. coti, несущие гены биосинтеза меланина. рВСС619 содержит ген тирозиназы, a pBGC620.3 — открытую рамку считывания (ORF438) для синтеза меланина и ген тирозиназы. Транскрипция клонированных генов осуществляется под контролем промотора РT7 бактериофага Т7. RBS1 и RBS2 -два разных сайта связывания рибосом. Обе плазмиды несут гены устойчивости к ампициллину (Ampr). |
Использование рекомбинантныхмикроорганизмов для получения коммерческихпродуктов 269

|
| Рис. 12.20. Синтетический олигонуклеотид, послуживший основой для создания гена адгезивного белка, синтезируемого мидией M. edulis. Второй синтетический олигонуклеотид был синтезирован таким образом, чтобы после отжига с первым образовывался фрагмент двухцепочечной ДНК с липкими концами. Последующее лигирование с помощью ДHК-лигазы фага Т4 привело к образованию линейной ДНК, состоящей из представленных на рисунке повторов. Внизу дана аминокислотная последовательность полипептида, кодируемого этим повтором. |
дов Ala-Lys-(Pro или Hyp)-Ser-(Tyr или DOPA)-Hyp-Hyp-Thr-DOPA-Lys.
Из библиотеки кДНК, которая была получена на основе мРНК, выделенной из биссаловой железы, была изолирована кДНК 130 кДа-предшественника адгезивного белка. И адгезивный белок, и его кДНК обладают весьма необычными свойствами, затрудняющими клонирование и экспрессию соответствующих генов и получение функционального адгезивного белка. Во-первых, кДНК содержит большое число повторов, что повышает частоту гомологичной рекомбинации и вероятность утраты части клонированной последовательности. Во-вторых, поскольку примерно 70% всех аминокислот белка приходится на долю пролина, лизина и тирозина, вряд ли его удастся получить в большом количестве вследствие ограниченности внутриклеточного пула аминоацил-тРНК.
Чтобы преодолеть все эти трудности, полноразмерную кДНК адгезивного белка или ее фрагменты встроили в дрожжевые экспрессирующие векторы и ввели эти векторы в дрожжевые клетки. После экспрессии были получены новые активные формы адгезивного белка мол. массой от 20 до 100 кДа, причем на их долю приходилось от 2 до 5% суммарного количества клеточных белков. Значительно более высокого уровня экспрессии удалось достичь после того, как был химически синтезирован ген адгезивного белка (рис, 12.20). Используя повторы ДНК, кодирующие декапептид адгезивного белка, создали синтетический ген длиной 600 п. н., который кодировал белок мол. массой примерно 25 кДа. Его основная повторяющаяся единица длиной 30 п. н. состояла из кодонов, оптимальных для экспрессии в Е. соli, а эффективнаяэкспрессия происходила, когда он находился под контролем промотора фага Т7. Большинство микроорганизмов обладают лишь ограниченной способностью осуществлять посттрансляционное гидроксилирование аминокислот, так что образующийся белок бывает не до конца гидроксилирован. Так, некоторые из его тирозиновых остатков не превращаются в DOPA, что снижает число образующихся поперечных сшивок. Чтобы решить эту проблему, была создана система гидроксилирования in vitro, в которой бактериальная тирозиназа в присутствии аскорбиновой кислоты гидрокcилировала остатки тирозина (рис. 12.21). Аскорбиновую кислоту добавляли в реакционную смесь для того, чтобы предотвра-
| Рbс. 12.21. Посттрансляционное гидроксилирование in vitro некоторых тирозиновых остатков адгезивного белка М. edulis. При участии тирозиназы тирозин превращается в DOPA, после чего он может быть окислен до о-хинона катехолоксидазой или тирозиназой. Окисление можно предотвратить добавлением аскорбиновой кислоты. | 
|
270 ГЛАВА 12
тить окисление остатков DOPA в о-хинон. Этот процесс должен строго контролироваться, поскольку он приводит к сшиванию субъединиц адгезивного белка. Как и многие другие клеи или адгезивы, адгезивный белок необходимо активировать непосредственно перед использованием.
При окислении предшественника адгезивного белка и образовании сшивок белок может связываться с разнообразными поверхностями -из стекла, полистирола, коллагена и т. д. Прочность и специфичность связывания можно изменять добавлением к смеси адгезивных белков до окисления и образования сшивок других белков. Это позволяет создавать клеи с уникальными свойствами, в том числе и такие, которые можно будет использовать в медицине, в частности в стоматологии.
Микробиологический синтез каучука
Натуральный каучук, цис-1,4-полиизопрен, – это широко используемый биополимер, который получают из различных растений. Его биосинтез начинается с превращения простых Сахаров и включает 17 ферментативных реакций. В ходе последней из них происходит полимеризация изопентенилпирофосфата с образованием аллилпирофосфата.
Ввиду большой коммерческой ценности каучука были проведены исследования, направленные на то, чтобы выяснить, можно ли использовать для его получения рекомби-нантные микроорганизмы. Прежде всего с помощью мРНК из растения Hevea brasiliensis, синтезирующего каучук, была создана соответствующая к ДНК-библиотека. Затем проведена гибридизация с коротким ДНК-зондом, синтезированным исходя изданных об аминокислотной последовательности одного из участков молекулы полимеразы каучука. Для того чтобы доказать, что клонированная кДНК действительно кодирует этот фермент, использовали антитела к очищенному ферменту. Теперь, используя этот клон кДНК, а также, возможно, другие гены биосинтеза каучука, можно попытаться синтезировать натуральный каучук микробиологическими методами. С другой стороны, с помощью этой кДНК можно также получить полимеразу каучука и создать каталитическую систему in vitro. В любом случае исследования, которые могли бы привести к разработке нового пути биосинтеза каучука, имеет смысл продолжить.
Микробиологический синтез полигидроксиалканоатов
Полигидроксиалканоаты — это биодеградируемые полимеры, синтезируемые множеством микроорганизмов (прежде всего Alcaligenes eutrophus) и использующиеся ими как внутриклеточный источник углерода и энергии. Они обладают разными свойствами в зависимости от состава и могут применяться для получения биодеградируемых пластмасс, используемых, например, для изготовления упаковочного материала. По оценкам, годовой объем продаж биодеградируемых пластмасс составляет примерно 1,3 млрд. долларов.
Из всех полигидроксиалканоатов наиболее полно изучена и охарактеризована поли(3-гидроксимасляная кислота). Это относится как к самому полимеру, так и к кодирующим его синтез генам A. eutrophus. Поли(3-гидрокси-масляную кислоту), ее сополимер поли(3-гид-роксибутират-со-3-гидроксивалерат) и другой полиоксиалканоат, поли(3-гидроксивалериановую кислоту), получают в Великобритании в промышленном масштабе ферментацией при участии A. eutrophus.
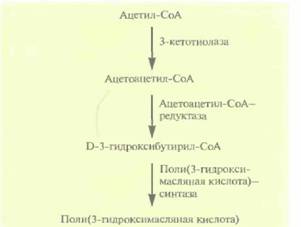
Однако этот микроорганизм растет относительно медленно и использует лишь ограниченное число источников углерода, что делает производство довольно дорогим. Можно использовать другой путь: при перенесении генов биосинтеза этого полимера в E. coli получаются быстрорастущие трансформанты, накапливающие в большом количестве (до 95% сухой массы клетки) поли(3-гидроксимасляную кислоту). Поли(3-гидроксимасляная кислота) синтезируется из ацетилСоА в три стадии, катализируемые тремя разными ферментами (рис. 12,22). Оперон, содержащий эти гены, был встроен в плазмиду в составе фрагмента длиной 5,2 т.п.н., однако в отсутствие селективного давления, например при росте в отсутствие антибиотиков, примерно половина клеток E. coli теряла данную плазмиду уже после 50 генераций. Это не очень существенно, когда масштабы культивирования малы, но становит-
Использование рекомбинантных микроорганизмов для получениякоммерческих продуктов 271
|
| Рис. 12.22. Синтез поли(3-гидроксимасляной кислоты) из ацетил-СоА, Справа от стрелок указаны ферменты, катализируюшие соответствуюшие реакции. |
ся серьезной проблемой при крупномасштабной или непрерывной ферментации (см. гл. 16). Чтобы обойти эту трудность, в плазмиду, несущую оперон поли(3-гидроксимасляной кислоты), встроили локус parВ из другой плазмиды, который обеспечивал стабилизацию плазмид, обусловливая гибель клеток, не содержащих плазмиды после сегрегации. Модифицированные плазмиды оставались стабильными даже при конститутивном синтезе поли(3-гидроксимасляной кислоты). Трансформанты Е. coli, синтезирующие данный продукт, образовывали лишь очень небольшое количество ацетата, гибельного для клеток, по-видимому, вследствие того, что весь избыточный ацетил-СоА превращался в поли(3-гидроксимасляную кислоту), а не в ацетат. Еще одно преимущество синтеза поли(3-гидроксимасляной кислоты) в E. coli состоит в том, что когда ее экстрагируют щелочным раствором хлорноватистокислого натрия (калия), то она разлагается в меньшей степени, чем при экстракции из A. eutrophus. По-видимому, это связано с тем, что большая часть полимера, синтезируемого в E. coli, находится в кристаллическом виде, в то время как в A. eutrophus — в аморфном. При этом полимеры, получаемые этими двумя способами, идентичны.
Поли(3-гидроксибутират-со-3-гидроксива-лерат) аналогичен по своим свойствам широко использующемуся полипропилену, так что получение его микробиологическими методами может представлять коммерческий интерес. Однако штаммы E. coli, в которых экспрессируются гены биосинтеза полимера, синтезируют только поли(3-гидроксимасляную кислоту), а не сополимер. Эту проблему можно решить, используя для экспрессии клетки E. coli, несущие мутации в локусах fadR и atoC. fadR ответствен за негативную регуляцию биосинтеза жирных кислот, a atoC — за позитивную регуляцию их поглощения. Роль локуса fааR в индукции биосинтеза сополимера неясна, но продукт гена atoC влияет на синтез белков, кодируемых генами atoA и atoD и облегчающих поглощение бактериями пропионата из культуральной среды. Последний превращается в пропионил-СоА и затем реагирует с ацетил-СоА с образованием 3-
| Рис. 12.23. Микробиологический синтез поли(3-гидроксибутирата-со- 3- гидроксивалерата). | 
|
Дата добавления: 2015-04-16; просмотров: 270; Мы поможем в написании вашей работы!; Нарушение авторских прав |