
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 13
| Таблица 13.2. Время генерации дикого и трансформированного психрофильных штаммов P. putida, использующих в качестве единственного источника углерода салицилат или толуат, при разных температурах1) | |||
| Температура, °С | Время генерации, ч | ||
| штамм дикого типа, салицилат2) | трансформированный штамм, салицинaт | трансфирмированный штамм, толуат | |
| Не растет | Не растет | Не растет | |
| 2,2 | 2,5 | 2,0 | |
| 2,1 | 3,2 | 1.3 | |
| 2,6 | 3,8 | 1,9 | |
| 3,2 | 4,2 | 2,9 | |
| 6,3 | 5,6 | 3,3 | |
| 13,9 | 12,9 | 12,2 | |
| 18,6 | 18,1 | 24.4 | |
| 1) Из работы Кolenc et al, Appl. Environ. Microbiol. 54:638 Ml, 1988, с изменениями. | |||
| 2) Штамм дикого типа не может утилизировать толуат ни при какой температуре, поскольку у него отсутствуют необходимые для этого ферменты. |
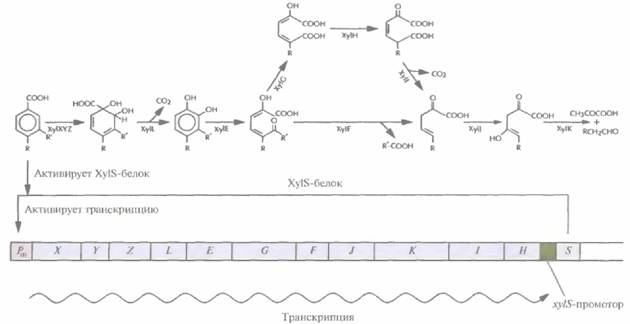
иного метаболического пути. Осуществимость этого подхода проверяли на примере плазмиды pWWO, 12 генов которой кодируют мета-расщепление толуола и ксилола. Обладающие этой плазмидой псевдомонады могут использовать в качестве источника углерода алкилбензоаты (рис. 13.6). Указанные гены входят в состав одного xyl-оперона, находящегося под контролем Pm-промотора. Транскрипционная активность последнего находится под позитивным контролем продукта гена xylS, активируемого почти всеми субстратами данного метаболического пути (например, бензоатом и 3-метилбензоатом) (рис. 13.6). Детальный биохимический и генетический анализ показал, что несущие pWWO-плазмиду бактерии могут расщеплять 4-этилбензоат только до 4-этилкатехола, который инактивирует один из основных ферментов данного метаболического пути, катехол-2,3-диоксигеназу, являющуюся продуктом гена xylE, и поэтому не разрушается и накапливается в среде. Кроме того, 4-этилбензоат, в отличие от остальных алкилбензоатов, не активирует XylS-белок; поэтому, если он является единственным субстратом, xyl-оперон не транскрибируется. Для усовершенствования природной системы мета-расщепления алкилбензоатов необходимо решить две основные задачи: 1) предотвратить инактивацию катехол-2,3-диоксигеназы 4-этил-бензоатом; 2) индуцировать транскрипцию генов xyl-оперона в том случае, если единственным субстратом является 4-этилбензоат.
Для решения второй задачи был проведен поиск мутантной плазмиды. Для этого в плазми-ду, несущую ген устойчивости к ампициллину, встроили ген устойчивости к тетрациклину, находящийся под контролем Pm-промотора. В другую плазмиду, несущую ген устойчивости к ка-намицину, встроили ген xylS. Полученными конструкциями трансформировали E. соli, отобрали клетки, содержащие обе плазмиды, по признаку устойчивости к ампициллину и канамицину (рис, 13.7, А), обработали их мутагеном этилметансульфонатом и вырастили на среде, содержащей тетрациклин и 4-этилбензоат. Растущие на этой среде клетки содержат мутантный ген xylS ипродуцируют измененный XylS-белок (S*), который способен взаимодействовать с 4-этилбензоатом и активировать транскрипцию гена устойчивости к тетрациклину. Чтобы решить проблему инактивации катехол-2,3-диоксигеназы, мутантный ген xylS встроили в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину, и ввели ее в клетки P. putida, содержащие плазмиду pWWO (рис. 13,7, Б). Трансформированные клетки высеяли с высокой плотностью на чашки с минимальной средой, содержащей 4-этилбензоат в качестве единственного источника углерода, канамицин для отбора клеток с плазмидой и этилметансульфонат. Клетки, растущие на этой среде, вырабатывают измененную катехол-2,3-диоксигеназу, которая не ингибируется 4-этил-катехолом. Дополнительный анализ подтвер-
Биодеградация и утилизациябиомассы 283
|
| Рис. 13.6. Путь мета-расщеплениятолуола и ксилола и хуl-оперон плазмиды pWWO. xyl-Oпepoннаходится под контролем Pm-промотора, который регулируется с помощью продукта гена xylS, в свою очередь активируемого одним из исходных субстратов. Гены xylX—xylH находятся под контролем Pm-промотора. Ген хуS невходит в состав оперона и экспрессируется конститутивно. Исходным субстратом может быть бензоат (R и R' — это Н), 3-метилбензоат (R — это H, R' — это СН3), 3-этилбензоат (R — это H, R' — это СН2СН3) и 4-метилбензоат(R — это СН3, R' — это Н). Гены xylXYZ кодируют толуолдиоксигеназу, xylL — дигидроксициклогексадиенкарбоксилатдегидрогеназу, xylE— катехол-2,3-диоксигеназу, xylF— гидролазу полуальдегида гидроксимуконовой кислоты, xylG— дигидрогеназу полуальдегида гидроксимуконовой кислоты, xylH — 4-оксалокротонат-таутомеразу, xyll — 4-оксалокротонатдекарбоксилазу, xylJ — 2-оксопента-4-еноатгидратазу, xylK—2-оксо-4-гидроксипентонатальдолазу. |
дил, что в гене катехол-2,3-диоксигеназы pWWO действительно произошла мутация и что два мутантных гена (xylS и ген катехол-2,3-диоксигеназы) обеспечивают расщепление 4-этилбензоата.
Оба модифицированных гена участвуют в процессе деградации всех субстратов данного метаболического пути. Поэтому стратегия, использованная для повышения эффективности расщепления 4-этилбензоата, применима и в случае других соединений: мутация, приводящая к гиперпродукции XylS-белка, может усиливать активацию Рт-промотора и повышать скорость разрушения субстрата; кроме того, можно избирательно модифицировать Рm-промотор, чтобы он стал более сильным, сохранив способность взаимодействовать с XylS-белком. Таким образом, проведенная работа показывает, что вполне реально усовершенствование того или иного катаболического пути с помощью технологии рекомбинантных ДНК, традиционного мутагенеза и соответствующих методов отбора.
Одним из наиболее распространенных веществ, загрязняющих почву и воду, является трихлорэтилен, широко использующийся в качестве растворителя и обезжиривающего средства. Он длительное время остается в окружающей среде и считается канцерогеном. Кроме того, анаэробные почвенные бактерии могут дегалогенировать его, превращая в еще более токсичное соединение винилхлорид.
Было показано, что некоторые штаммы P. putida, разрушающие ароматические соединения, такие как толуол, разрушают и трихлорэтилен. С помощью проведенных генетических исследований удалось установить, что для полной детоксикации трихлорэтилена не нужны все ферменты мета-расщепления ксилола и толуо-
284 ГЛАВА 13
Л
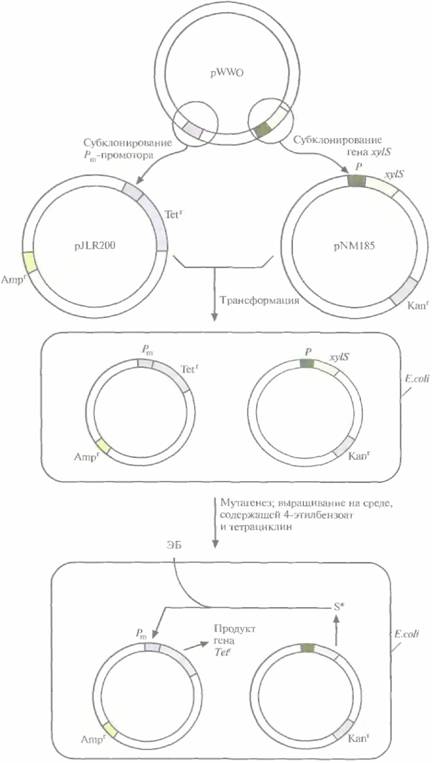
| Рис. 13.7. А. Создание системы синтеза XylS- белка, активируемого 4-этилбензоатом. Сначала заменяют промотор гена устойчивости к тетрациклину в плазмиде pBR322 Рт- промотором и получают плазмиду pJLR200. Затем ген xylS cсобственным промотором встраивают в плазмиду с широким кругом хозяев, несущую ген устойчивости к канамицину. Полученными плазмидами трансформируют E. coli. Отбирают трансформированные клетки по признаку устойчивости к ампициллину и канамицину и подвергают мутагенному действию этилметансульфоната. В клетках, несущих мутантный ген xylS (S*), XylS-белок активируется 4-этилбензоатом (ЭБ), активируя в свою очередь Рm-промотор, поэтому они могут расти на среде, содержащей 4-этилбенэоат и тетрациклин. |
Биодеградация и утилизация биомассы 285
| Рис. 13.7. (Продолжение) Б. Создание системы синтеза модифицированной катехол2,3-диоксигеназы, которая не ингибируется 4-этилкатехолом. Штамм Р, putida, несущий плазмиду pWWO, трансформируют плазмидой с широким кругом хозяев, содержащей мутантный гeн xylS*, продукт которого активирует Рm- промотор. Проводят химический мутагенез трансформированных клеток и выращивают их на минимальной среде, содержащей 4-этилбензоат и канамицин. Клетки, растущие на этой среде, содержат мутантный ген катехол2,3-диоксигеназы (мутация X в середине xyl-оперона). | 
|
ла, достаточно лишь толуолдиоксигеназы, которая в норме катализирует реакцию окисления толуола до цис-толуолдигидродиола.
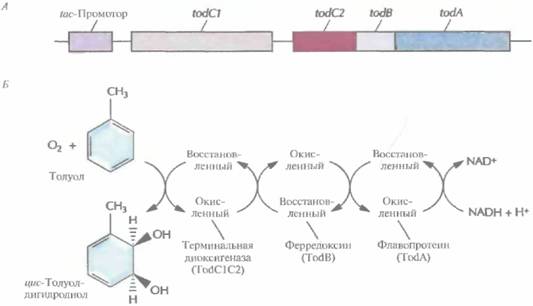
Образование функциональной толуолдиоксигеназы кодируется четырьмя генами (рис. 13.8, А). Их выделили и экспрессировали в Е. coli под контролем сильного индуцибельного tac-промотора, который активируется изопропил-ß-D-тиогалактопиранозидом (ИПТГ), в результате чего трихлорэтилен разлагается до безвредных соединений. Исходная скорость деградации трихлорэтилена в E. coli ниже, чем в P. putida, но она сохраняется в Е. соli дольше. С этим различием может быть связана меньшая, чем у P. putida, чувствительность E. coli к повреждающему действию трихлорэтилена.
В одном из вариантов этого эксперимента был создан рекомбинантный штамм Pseudomonas, в котором были объединены элементы двух разных катаболических путей. Бактериальные штаммы, способные разрушать бифенил, содержат бифенилдиоксигеназу. В состав этого ферментного комплекса входят состоящая из двух субъединиц терминальная диоксигеназа, ферредоксин и ферредоксинредуктаза. По своим структуре и функции бифенилдиоксигеназа сходна с толуолдиоксигеназой, однако утилизирующие бифенил псевдомонады не могут расти на толуоле, а штаммы, утилизирующие толуол, не растут на бифениле. После того как в штамме KF715 P. putida ген bphAq, кодирующий большую субъединицу бифенилдиоксигеназы, был
286 ГЛАВА 13
|
| Рис. 13.8. А. Клонированный оперон толуол диоксигеназы, находящийся под контролем tac-промотора E, coli. Образование толуолдиоксигеназы обеспечивают четыре гена (todA, todB, todC1 и todC2). Ген todA кодирует флавопротеин, который акцептирует электроны с восстановленного никотинамидадениндинуклеотида (NADH) и переносит их на ферредоксин. Последний кодируется геном todB и восстанавливает терминальную диоксигеназу, кодируемую генами todCîw todC2. Эти гены эквивалентны генам xylXYZna рис. 13.6, Б. Превращение толуола в цис-толуолдигидродиол в результате совместного действия Tod-белков. |
заменен с помощью гомологичной рекомбинации на кодирующий большую субъединицу толуолдиоксигеназы ген todC1 из штамма F1 P, putida, получили штамм, способный эффективно разрушать трихлорэтилен (табл. 13.3), Кроме того, этот штамм растет на многих ароматических соединениях, а следовательно, есть возможность создания микроорганизмов, способных разрушать сразу несколько разных соединений.
Утилизация крахмала и сахаров
Крахмал, основной резервный полисахарид растений, представляет собой смесь гомополимеров D-глюкозы — как линейных (амилоза), так и разветвленных (амилопектин). Молекула амилозы состоит из 1-102—4-105 остатков D-глюкозы, соединенных α-1,4-связями (рис. 13.9, A), a амилопектина - из коротких (17—23 остатков D-глюкозы, соединенных
| Таблица 13.3, Рост родительских и рекомбинантного штаммов Pseudomonas на разных ароматических соединениях 1) | |||||
| Штамм | Рост на 2) | ||||
| бифениле | дифенилметане | толуоле | бензоле | трихлорэтилене | |
| P. putida КF715 | +++ | +++ | - | - | - |
| P. putida F1 | - | - | +++ | +++ | + |
| P. putidaKF715-D53) | ++ | + | +++ | +++ | +++ |
| 1) Из работы Suyama et al, J. Bacterial. 178: 4039-4046, 19%, с изменениями. | |||||
| 2) Обозначения: +++ хороший рост; ++ умеренный рост; + плохой рост; — очень плохой рост или нет роста. | |||||
| 3) Штамм KF715-D5 P. putida получен путем замены гена bphA1 вштамме КF715 на ген todC1 из штамма F1. |
Биодеградация и утилизациябиомассы 287
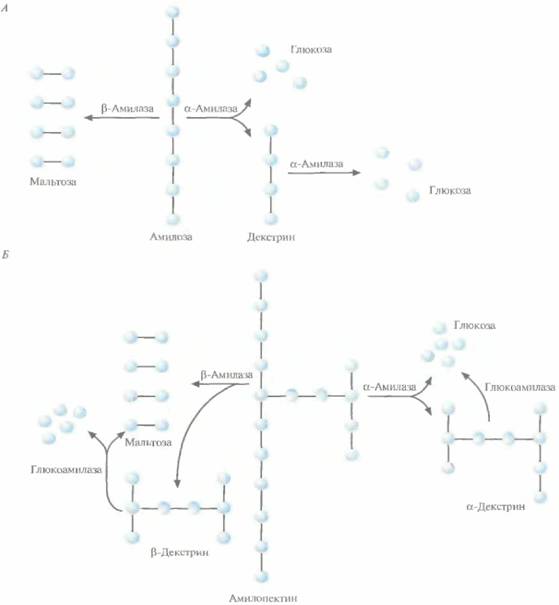 Рис. 13.9. А. Ферментативный гидролиз амилозы. Б. Ферментативный гидролиз амилопектина. Голубые кружки — остатки D-глюкозы.
Рис. 13.9. А. Ферментативный гидролиз амилозы. Б. Ферментативный гидролиз амилопектина. Голубые кружки — остатки D-глюкозы.
|
а-1,4-связями) линейных цепей, соединенных 1,6- и 1,3-связями и формирующих сильно разветвленную структуру, содержащую 1-104—4-107 остатков глюкозы (рис. 13.9, Б). Степень разветвления и соотношение между амилозой и амилопектином варьируют в зависимости от вида и возраста растения, из которого был получен крахмал.
Промышленное производство фруктозы и этанола
Крахмал широко используется в пищевой промышленности и пивоварении; при этом его сначала гидролизуют до низкомолекулярных компонентов, а затем превращают в другие соединения, преимущественно во фруктозу и этанол. Основ-
288 ГЛАВА 13
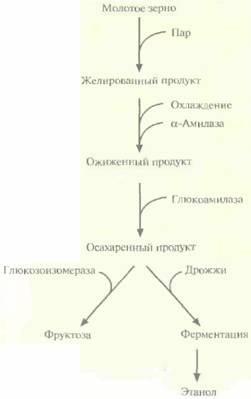
|
| Рис. 13.10. Промышленное производство фруктозы и этанола из крахмала. |
ные ферменты, необходимые для гидролиза крахмала и дальнейших превращении, — -амилаза, глюкоамилаза и глюкозоизомераза. Их стоимость составляет примерно 30% обшей стоимости всех ферментов, применяемых в настоящее время в промышленности.
Промышленное производство фруктозы и этанола из крахмала — это многоэтапный процесс, включающий следующие ферментативные и неферментативные стадии (рис. 13.10).
1. Желирование молотого зерна (обычно кукурузного, содержание крахмала в котором составляет примерно 40%), Для этого зерно обрабатывают паром под давлением, в результате чего разрушаются крахмальные зерна и крахмал становится доступным для последующего фрементативного гидролиза. Получаемый продукт имеет желеобразную консистенцию.
2. Ожижение. Желированный крахмал охлаждают до 50—60 °С и добавляют α-амилазу. При этом происходит гидролиз доступных а-1,4-связей и образуются низкомолекулярные полисахариды. Высокая температура повышает эффективность проникновения фермента в желированный крахмал и увеличивает скорость гидролиза,
3. Осахаривание (полный гидролиз) низкомолекулярных полисахаридов (как линейных, так и разветвленных) до молекул глюкозы. Происходит под действием глюкоамилазы.
Конечным продуктом такой обработки является глюкоза, из которой затем можно получить этанол (с помощью дрожжевой ферментации) или фруктозу (с помощью глюкозоизомеразы). Благодаря высокой эффективности последнего процесса вместо сахарозы при приготовлении пищи и в пивоварении в Северной Америке используют более дешевую фруктозу. Крахмал при промышленном производстве фруктозы обычно получают из кукурузы, поэтому его конечный продукт называют кукурузным сиропом с высоким содержанием фруктозы или просто сиропом с высоким содержанием фруктозы, хотя он состоит из примерно равных долей фруктозы и глюкозы.
Фермент α-амилаза гидролизует α-1,4-связи в молекулах амилозы и аминопектина случайным образом, при этом образуется смесь глюкозы, мальтозы (два остатка глюкозы, соединенные α-1,4-связью), мальтотриозы (три остатка глюкозы, соединенные α-1,4-связью) и ряд α-декстринов, которые представляют собой фрагменты амилопектиновых цепей с поперечными сшивками (рис. 13.9). α-Амилазу можно выделять из многих микроорганизмов, но для промышленных целей ее обычно получают из Bacillus amyloliquefaciens.
Иногда для расщепления крахмала вместо α-амилазы или одновременно с ней используют β-амилазу, которая гидролизует каждую вторую α-1,4-связь, начиная с концов цепей амилозы и амилопектина, в результате чего образуются остатки мальтозы и различные ß-декстрины.
Фермент глюкоамилаза гидролизует α-1,3-, α-1,4- и α-1,6-связи. Однако α-1,4-связи она гидролизует менее эффективно, чем -амилаза, и поэтому обычно используется совместно с
Биодеградация и утилизация биомассы 289

|
| Получение мультиплазмидных микроорганизмов, способных утилизировать несколько соединений |
| А. М. Чакрабарти U.S. paleni 4,259,444,198l |
| До появления технологии рекомбинантных ДНК одним из способов переноса генетического материала из одного микроорганизма в другой была конъюгация. Такой механизм обеспечивал перенос из клетки в клетку целых плазмид. А. М, Чакрабарти, проводивший эксперименты по переносу плазмид-"разрушительниц», т. е. плазмид, кодирующих все ферменты пути биодеградации определенного соединения, сконструировал штамм, содержащий несколько таких плазмид. Кодируемые плазмидными генами ферменты каждого катаболического | пути разрушали определенное органическое соединение. Взяв четыре разные бактерии, он создал один микроорганизм, содержащий плазмиды, которые обусловливали деградацию камфары, октана, салицилата и нафталина. Эта работа была новаторской и очень интересной не только с научной точки зрения (следует учесть, что она была проведена в начале 1970-х гг., до появления большинства генноинженерных методов). Она сыграла ключевую роль в официальном признании биотехнологии, поскольку данное изо- | бретение получило в марте 1981 г., почти через девять лет с момента подачи заявления, патент США. После того как Верховный суд США вынес решение в пользу Чакрабарти, создание микроорганизмов с помощью генноинженерных методов было признано изобретением, которое можно было патентовать наравне с другими. Это решение суда и последующая выдача патента сыграли не менее важную роль, чем сам научный эксперимент, стимулировав развитие биотехнологической промышленности. |
ней. Основная функция глюкоамилазы — расщепление поперечных сшивок в молекуле декстрина с превращением его в глюкозу. Этот и другие ферменты используются для уменьшения доли углеводов (декстринов) в нормальных сортах пива и получения так называемых светлых и сухих сортов. Обработку глюкоамилазой обычно проводят перед ферментацией, однако эти два процесса можно объединить. Глюкоамилазу синтезируют многие микроорганизмы, но обычно ее получают из грибов Aspergillus niger.
Повышение эффективности производства фруктозы и этанола
Стоимость производства этанола или фруктозы из молотого зерна в основном определяется стоимостью ферментов, которые обычно используются однократно. Поэтому разработка новых подходов недорогого широкомасштабного производства этих ферментов может существенно снизить стоимость конечных продуктов. Этого можно достичь несколькими способами.
• Использовать для сверх продукции ферментов быстрорастущие рекомбинантные микроорганизмы, утилизирующие недорогой субстрат. Это будет дешевле, чем получать ферменты из природных микроорганизмов.
• Использовать разновидности α-амилазы (встречающиеся в природе или созданные методами генной инженерии), которые обладают более высокой активностью и позволяют проводить ожижение при 80—90 °С. Это ускорит гидролиз желированного крахмала и сэкономит энергию, расходуемую на его охлаждение до температуры, при которой обычно проводят гидролиз.
• Модифицировать гены α-амилазы и глюкоамилазы таким образом, чтобы кодируемые ими ферменты имели одинаковые оптимумы температуры и pH. Это позволит совместить этапы ожижения и осахаривания.
• Найти или создать фермент, который будет эффективно расщеплять необработанный крахмал, что позволит исключить этап желирования и сэкономит большое количество энергии.
• Создать такой микроорганизм для ферментации, который будет синтезировать и сек-ретировать глюкоамилазу, что устранит необходимость ее добавления в процессе ферментации.
290 ГЛАВА 13
В настоящее время проводятся исследования, которые покажут, возможна ли разработка таких подходов.
Гены, кодирующие α-амилазу, были выделены из многих микроорганизмов, в том числе из В. amyloliquefaciens и термофильной бактерии В. stearothermophilus. Для этого экстрагировали их хромосомную ДНК, частично гидролизовали ее рестрицирующей эндонуклеазой Sau3Al и встроили в обработанную рестриктазой BamHI плазмиду pUB110, которая содержит уникальный BamHI-сайт и несет ген устойчивости к канамицину. Полученным банком клонов трансформировали не обладающие а-амилазной активностью клетки В. subtiUs, отобрали трансформированные клетки по признаку устойчивости к канамицину и тестировали их на способность к синтезу и секреции α-амилазы при помощи иод-крахмального теста. Для этого чашки с колониями, образованными трансформантами при 65 °С на содержащей крахмал твердой среде, поместили в пары иода. Колонии, продуцирующие α-амилазу, были окружены четко различимым гало, что свидетельствовало о гидролизе крахмала вблизи них. Положительный иод-крахмальный тест указывает на транскрипцию гена α-амилазы под контролем своего промотора (вектор не содержит промотора) и на наличие сигнала, необходимого для секреции (молекулы субстрата велики и не могут проникнуть в клетку). Возможность получения генов α-амилазы из разных источников позволила исследователям внести в них изменения, необходимые для того, чтобы эти гены можно было использовать в конкретных промышленных процессах.
Возможность исключения этапа осахаривания при производстве этанола из крахмала была доказана следующим образом. Выделенную из грибов Aspergillus awamori полноразмерную кДНК глюкоамилазы встроили в одну из плазмид Saccharomyces cerevisiae так, чтобы она находилась под контролем промотора и регуляторных последовательностей терминации транскрипции гена енолазы дрожжей (ENO1). «Лабораторный» штамм S. cerevisiae, трансформированный этой плазмидой, приобрел глюкоамилазную активность и мог превращать растворимый крахмал в этанол.
К сожалению, некоторые свойства этого штамма (чувствительность к высокой концентрации этанола, неэффективность экспрессии кДНК глюкоамилазы, поддержание плазмид только при определенном давлении отбора) делают его непригодным для промышленного использования. Однако эти недостатки удалось устранить. Во-первых, продукцию глюкоамилазы повысили примерно в 5 раз, удалив из плазмиды область отрицательной регуляции ENO1-промотора длиной 175 п. н. Во-вторых, из плазмиды удалили «дрожжевой* сайт инициации репликации и встроили в нее сегмент ДНК, гомологичный участку дрожжевой хромосомы, превратив ее тем самым в интегрирующий вектор, который встраивается в дрожжевую хромосому и стабильно поддерживается в клетке. В-третьих, в качестве клетки-хозяина для модифицированной таким образом плазмиды использовали другой штамм S. cerevisiae (пивные дрожжи), устойчивый к высокой концентрации этанола,
В результате получили два новых штамма дрожжей, которые гидролизуют и ферментируют растворимый крахмал более эффективно, чем близкие к S. cerevisiae природные амилолитические (гидролизующие крахмал) дрожжи S. diastaticus (табл. 13.4). «Пивной» штамм S. cerevisiae с встроенным в хромосому геном глюкоамилазы действовал более эффективно, чем «лабораторный» с тем же геном в составе многокопийной плазмиды, что, по-видимому, свидетельствует о ее нестабильности и утрате введенного гена глюкоамилазы. Как «лабораторный», так и «пивной» штаммы S. cerevisiae до введения в них гена глюкоамилазы не могли утилизировать растворимый крахмал. Плазмидная и интегрированная кДНК глюкоамилазы A. awamori находилась под контролем регуляторных последовательностей гена ENO1, откуда была удалена область отрицательной регуляции длиной 175 п. н. Для поддержания плазмиды создавалось определенное селективное давление.
Для повышения продукции глюкоамилазы в хромосомную ДНК грибов A. niger встроили несколько копий ее гена. Оказалось, что активность глюкоамилазы не коррелирует с числом копий гена, но сильно зависит от того, в какой участок хромосомы они были встроены. Таким образом, простого увеличения числа копий гена
Биодеградация и утилизация биомассы 291
| Таблица 13.4. Расщепление растворимого крахмала (25%, в/о) разными штаммами дрожжей1) | |||
| Штамм | Утилизация углеводов, % | Производство этанола, г/л | Выход этанола, г/г субстрата |
| «Лa6opaторный» | <0,1 | ||
| «Лабораторный» + плазмида | 75,6 | 0.41 | |
| «Пивной» | <1 | 3,1 | |
| «Пивной» + встроенный ген | 118,2 | 0,48 | |
| В. diastaticus | 44,2 | 0,38 | |
| 1) Из работы Cole et аl., Βίο/Technology 6: 417— 421, 1988, с изменениями. |
недостаточно для повышения продукции активного фермента.
Фермент глюкозоизомеразу следовало бы назвать ксилозо/глюкозоизомеразой, поскольку основная катализируемая им реакция — это превращение пятиуглеродного моносахарида D-ксилозы в D-ксилулозу, а реакция изомеризации D-глюкозы в D-фруктозу является побочной. Ксилозо/глюкозоизомераза имеет более низкую каталитическую константу kcat и более высокую константу связывания КMдля глюкозы, чем для ксилозы; это означает, что ксилоза прочнее связывается с ферментом и быстрее превращается в ксилулозу, чем глюкоза превращается во фруктозу.
С помощью внутриклеточных ферментов, к которым относится ксилозо/глюкозоизомераза, не удается получать продукты такой же степени чистоты и в таком же количестве, как в случае внеклеточных (секретируемых) ферментов. Большинство ферментов, используемых в промышленных процессах, не подвергаются тщательной очистке, а в препарате внеклеточного фермента обычно содержится гораздо меньше белковых примесей, чем в экстракте внутриклеточного. Кроме того, для получения экстракта внутриклеточного фермента необходимо отделить клетки от культуральной среды, механически их разрушить и удалить образовавшиеся фрагменты. Все это повышает стоимость конечного продукта - ксилозо/глюкозоизомеразы. Чтобы решить эту проблему, можно иммобилизовать фермент на твердом носителе и использовать его многократно.
Изомеризация глюкозы с образованием фруктозы — обратимая реакция, конечное содержание образующейся в ее ходе фруктозы находится в прямой зависимости от температуры, которая в большинстве производственных процессов составляет примерно 60 °С. Повысив температурный оптимум и термостабильность ксилозо/глюкозоизомеразы, можно увеличить выход фруктозы.
Термофильная бактерия Thermus thermophilus продуцирует ксилозо/глюкозоизомеразу, которая сохраняет свою активность и остается стабильной при 95°С, а потому представляется весьма перспективной для промышленного использования. К. сожалению, природный штамм T. ihermophilus вырабатывает ее в небольшом количестве. Чтобы устранить этот недостаток, выделили ген ксилозо/глюкозоизомеразы 71 tfter-mophilus и осуществили его экспрессию в Е, coli и В. brevls с использованием разных промоторов и разных сайтов связывания с рибосомой (табл. 13.5). В последней из представленных в табл. 13.5 систем фермент вырабатывался в количестве, более чем в 1000 раз превышающем исходное, что позволяет использовать ее для промышленного получения фруктозы.
Есть еще одна возможность — повысить субстратную специфичность фермента. В одной из серий экспериментов с помощью сайт-специфического мутагенеза заменяли нуклеотиды, кодирующие одну или две аминокислоты ксилозо/глюкозоизомеразы термофильной бактерии Clostridium thermosulfurogenes. Выбор сайтов для модификации основывался на данных об участии соответствующих аминокислот в связывании субстрата. Замена триптофана в положении 139 на фенилаланин или валина в положении 186 на треонин привела к повышению каталитической эффективности (kcat/KM,) фермента в отношении глюкозы в 1,7 и 2,6 раза соответственно (табл. 13.6) и к ее уменьшению для ксилозы в 2 и 7 раз. При одновременной замене двух аминокислот каталитическая эффективность в отношении глюкозы повысилась в 5,7 раза, а в от-
292 ГЛАВА 13
| Таблица 13.5. Активность ксилозо/глюкозоизомеразы T. thermophilus в разных бактериях1) | |||||
| Бактерия 2) | Число копий плазмиды | Промотор | Сайт связывания с рибосомой | Ферментативная активность, ЕД/л | |

| |||||

| |||||
| Таблица 13.6. Каталитическая эффективность природной и мутантных форм ксилозо/глюкозоизомеразы С. thermosulfurogenes1) | |

| |
| 1)Из работы Meng et al,. Proc. Natl. Acaä. Sci, USA 88::4015-4019. 1991. с измененными. |
ношении ксилозы снизилась в 4,5 раза. Таким образом, двойная замена привела к тому, что фермент, который исходно был в 17 раз активнее в отношении ксилозы, стал в 1,5 раза активнее в отношении глюкозы. Изменение специфичности и повышение термостабильности ксилозо/глюкозоизомеразы, которого удалось достичь, позволит использовать ее для промышленного превращения глюкозы во фруктозу,
Zymomonas mobilis
Сбраживание субстрата при промышленном производстве этанола осуществляют в основном с помощью S. cerevisiae, но вместо нее можно было бы использовать бактерию Zymomonas mobilis. Это грамотрицательная палочка, которая сбраживает глюкозу, фруктозу и сахарозу с относительно большим выходом этанола (табл. 13.7). По-видимому, это связано со снижением ее пролиферации (прироста биомассы) в ходе ферментации и уменьшением количества расходуемого на это субстрата, который теперь идет на образование этанола. Расщепляя 1 моль глюкозы, дрожжи вырабатывают 2 моля ATP, a использующая другой метаболический путь Zymomonas — 1 моль. Исторически сложилось так, что Zymomonas использовали для ферментации при производстве алкогольных напитков в тропических странах (например, в Мексике для производства напитка, называемого пулька, который содержит 3—5% спирта и вырабатывается из сока агавы).
Основное различие между Zymomonas и S. cerevisiae как продуцентами этанола заключается в скорости его образования. У Zymomonas она гораздо выше (табл. 13.7). Однако существуют некоторые биологические и технические ограни-
| Таблица 13. 7. Сравнение Z. mobilis и S. cerevisiae как продуцентов этанола1) | ||
| Показатель 1) | Значение для: | |
| Z. mobilis | S. cerevisiae | |
| Превращение сахара в этанол, % | ||
| Максимальная концентрация этанола. % | ||
| Скорость продукции этанола, г · г–1 · ч-1 | 5,67 | 0,67 |
| Объемная скорость продукции этанола, г · л-1 · ч-1 | ||
| Допустимая концентрация сахара, % | >40 | >40 |
| Диапазон pH | 3,5-7,5 | 2-6,5 |
| Оптимальная температура, °С | 25-30 | 30-38 |
| 1) Из работы Buchholz et al„ Trends Bivtechnol. 5: 199-204, 1987. | ||
| 2) Скорость продукции этанола умеряли в стандартных условиях ферментации, объемную скорость — в непрерывной культуре. |
Биодеградация и утилизация биомассы 293
чения, не позволяющие использовать Zymomonas для промышленного производства этанола: 1) небольшое число углеродных субстратов, которые она может использовать для синтеза этанола; 2) проблемы, возникающие при поддержании в ней клонирующих векторов с широким кругом хозяев, а значит, и чужеродных генов; 3) природная устойчивость к наиболее распространенным антибиотикам, что не позволяет при проведении экспериментов по клонированию использовать стандартные маркерные системы устойчивости к антибиотикам.
Несмотря на все это ученым удалось встроить и экспрессировать в Zymomonas некоторые чужеродные гены. Большинство проведенных экспериментов были направлены на расширение спектра утилизируемых ею субстратов. Так, в Zymomonas были введены гены ферментов, гидролизующих лактозу, крахмал, целлюлозу, ксилозу и целлобиозу. Трансформированные клетки экспрессировали все эти гены, но в большинстве случаев не могли использовать перечисленные выше субстраты в качестве единственного источника углерода. Придать Zymomonas новые катаболические свойства оказалось весьма непросто, хотя по крайней мере в одном случае удалось использовать этот микроорганизм для получения этанола из отходов, содержащих ксилозу.
В самом начале работы по созданию штаммов Z. mobilis, способных расти и продуцировать этанол с использованием ксилозы в качестве субстрата, в эту бактерию ввели гены глюкозо/ксилозоизомеразы и ксилулокиназы — ферментов, необходимых для утилизации ксилозы. Но полученные трансформанты не могли использовать образующиеся при расщеплении ксилозы пентозы (ксилулозо-5-фосфат, рибулозо-5-фосфат и рибозо-5-фосфат). Поэтому на следующем этапе в Z, mobilis ввели плазмиду, несущую два синтетических оперона, один из которых кодировал два фермента, расщепляющих ксилозу, а другой — два фермента, метаболизирующих пентозу (транскетолазу и трансальдолазу) (рис. 13.11). Транскрипция генов первого оперона находилась под контролем сильного конститутивного промотора гена глицеральдегид-3-фос-фатдегидрогеназы Z. mobilis, а второго — под контролем промотора гена енолазы Z. mobilis. Эти два синтетических оперона встроили в челночный вектор E. coli—Z. mobilis, которым и трансформировали Z. mobilis. Как и ожидалось, трансформированные клетки утилизировали ксилозу и преобразовывали пентозы до фрукто-зо-6-фосфата и глицеральдегид-3-фосфата, которые затем превращались в этанол по пути Энтнера—Дудороффа. Более того, трансформанты эффективно росли на глюкозе, ксилозе и их смеси и превращали ксилозу в этанол с большим выходом последнего. Эта работа продемонстрировала возможность генноинженер-
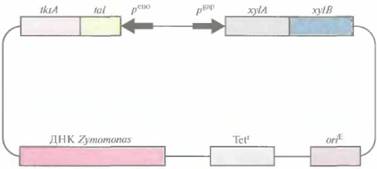
|
| Рис. 13.11. Челночный вектор Zymomonas— E. coli, несущий два оперона, один из которых содержит гены ферментов, необходимых для утилизации ксилозы (xylA и xylB), a другой — гены ферментов, участвующих в метаболизме пентозы (tktA и tal). Стрелками указано направление транскрипции с каждого промотора peno - промотор гена енолазы, рgap промотор гена глицеральдегид-3-фосфатдегидрогеназы, xylA ген ксилозоизомеразы, xylB- генксилулокиназы, tktA - ген транскетолазы, tal- ген трансальдолазы. Tetr - ген устойчивости к тетрациклину, oriE - точка инициации репликации E. coli. ДНК Zymomonas содержит собственную точку инициации репликации. |
Дата добавления: 2015-04-16; просмотров: 288; Мы поможем в написании вашей работы!; Нарушение авторских прав |