
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
окисно-відновних систем у водних розчинах
⇐ ПредыдущаяСтр 39 из 39
| Система | φ0 , В |
AgCl + ē = Ag + Cl 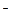
| + 0,222 |
Ag  + ē = Ag + ē = Ag
| + 0,800 |
As 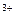 +3ē = As +3ē = As
| + 0,300 |
Br  + 2ē = 2Br + 2ē = 2Br 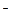
| + 1,087 |
BrO  + 3H + 3H  O + 6ē = Br O + 6ē = Br 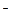 + 6OH + 6OH 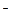
| + 0,610 |
Cl  + 2ē = 2Cl + 2ē = 2Cl 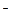
| + 1,359 |
2HClO + 2H  + 2ē = Cl + 2ē = Cl  + 2H + 2H  O O
| + 1,630 |
ClO  + 6H + 6H  + 6ē = Cl + 6ē = Cl 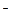 + 3H + 3H  O O
| + 1,450 |
ClO  + 3H + 3H  O + 6ē = Cl O + 6ē = Cl 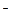 + 6OH– + 6OH–
| + 0,630 |
CrO 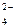 + 4H + 4H  O + 3ē = Cr O + 3ē = Cr 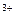 + 8OH + 8OH 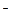
| – 0,125 |
CrO 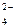 + 4H + 4H  + 3ē = CrO + 3ē = CrO 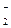 + 2H2O + 2H2O
| + 0,945 |
Cr2O  + 14H + 14H  + 6ē = 2Cr + 6ē = 2Cr 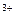 + 7H2O + 7H2O
| + 1,333 |
Cu  + ē = Cu + ē = Cu 
| + 0,158 |
F  + 2ē = 2F + 2ē = 2F 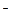
| + 2,870 |
Fe 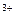 + ē = Fe + ē = Fe 
| + 0,771 |
Fe(CN) 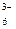 + ē = Fe(CN) + ē = Fe(CN) 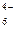
| + 0,356 |
FeO 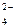 + 8H + 8H  + 3ē = Fe + 3ē = Fe 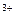 + 4H + 4H  O O
| + 1,700 |
2H  + 2ē = H + 2ē = H 
| + 0,000 |
H  + 2ē = 2H + 2ē = 2H 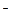
| – 2,251 |
H  O O  – 2ē = O – 2ē = O  + 2H + 2H 
| – 0,682 |
H  O O  + 2ē = 2OH + 2ē = 2OH 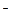
| + 0,880 |
H  O O  + 2H + 2H  + 2ē = 2H + 2ē = 2H  O O
| + 1,776 |
Hg  + 2ē = Hg + 2ē = Hg
| +0,854 |
I  + 2ē = 2I + 2ē = 2I 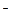
| + 0,536 |
HIO + H  + 2ē = I + 2ē = I 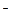 + H + H  O O
| + 0,990 |
2IO  + 12H + 12H  +10ē = I +10ē = I  + 6H + 6H  O O
| + 1,190 |
IO  + 3H + 3H  O + 6ē = I O + 6ē = I 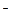 + 6OH + 6OH 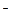
| + 0,260 |
MnO  + 4H + 4H  + 2ē = Mn + 2ē = Mn  + 2H + 2H  O O
| + 1,228 |
MnO 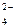 + 4H + 4H  + 2ē = MnO + 2ē = MnO  + 2H + 2H  O O
| + 2,257 |
MnO 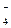 + ē = MnO + ē = MnO 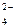
| + 0,564 |
| Система | φ0 , В |
MnO 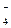 + 2H + 2H  O + 3ē = MnO O + 3ē = MnO  + 4OH + 4OH 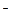
| + 0,600 |
MnO 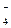 + 8H + 8H  + 5ē = Mn + 5ē = Mn  + 4H + 4H  O O
| + 1,507 |
MnO 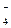 + 4H + 4H  + 3ē = MnO + 3ē = MnO  + 2H + 2H  O O
| + 1,692 |
HNO  + H + H  + ē = NO + H + ē = NO + H  O O
| + 1,004 |
NO  + 2H + 2H  + 2ē = NO + 2ē = NO 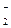 + H + H  O O
| + 0,838 |
NO  + 2H + 2H  + ē = NO + ē = NO  + H + H  O O
| + 0,772 |
NO  + 4H + 4H  + 3ē = NO + 2H + 3ē = NO + 2H  O O
| + 0,957 |
2NO  + 12H + 12H  + 10ē = N + 10ē = N  + 6H + 6H  O O
| + 1,24 |
NO  + 10H + 10H  + 8ē = NH + 8ē = NH 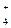 + 3H + 3H  O O
| + 0,880 |
Ni(OH)  + ē = Ni(OH) + ē = Ni(OH)  + OH + OH 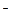
| + 0,49 |
O  + 2H + 2H  + 2ē = O + 2ē = O  + H + H  O O
| + 2,075 |
O  + 2H + 2H  O + 4ē = 4OH O + 4ē = 4OH 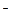
| + 0,401 |
P + 3H  O + 3ē = PH O + 3ē = PH  + 3OH + 3OH 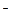
| – 0,890 |
H  PO PO  + 2H + 2H  + 2ē = H + 2ē = H  PO PO  + H + H  O O
| – 0,276 |
Pb 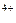 + 2ē = Pb + 2ē = Pb 
| + 1,694 |
Pb  + 2ē = Pb + 2ē = Pb
| – 0,130 |
PbO  + 4H + 4H  + 2ē = Pb + 2ē = Pb  + 2H + 2H  O O
| + 1,455 |
PbO  + SO + SO 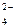 + 4H+ + 2ē = PbSO + 4H+ + 2ē = PbSO  + 2H + 2H  O O
| + 1,685 |
PtCl  + 2ē = PtCl + 2ē = PtCl 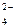 + 2Cl– + 2Cl–
| + 0,720 |
S + 2ē = S 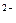
| + 0,480 |
SO 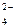 + H + H  O + 2ē = SO O + 2ē = SO 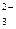 + 2OH + 2OH 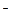
| – 0,932 |
SO 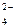 + 4H + 4H  + 2ē = H + 2ē = H  SO SO  + H + H  O O
| + 0,172 |
SO 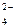 + 8H + 8H  + 6ē = S + 4H + 6ē = S + 4H  O O
| + 0,357 |
SO 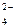 + 8H + 8H  + 8ē = S + 8ē = S 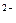 + 4H + 4H  O O
| + 0,149 |
SO 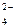 + 10H + 10H  + 8ē = H + 8ē = H  S + 4H S + 4H  O O
| + 0,31 |
S 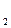 O O 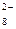 + 2ē = 2SO + 2ē = 2SO 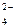
| + 2,010 |
Sn 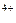 + 2ē = Sn + 2ē = Sn 
| + 1,151 |
Tl 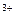 + 2ē = Tl + 2ē = Tl 
| + 1,280 |
V 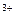 + ē = V + ē = V 
| – 0,255 |
Sn + 2ē = Sn + 2ē = Sn
| – 0,14 |
ЗМІСТ
| Правила роботи в хімічній лабораторії…………………………………….......... | |
| Рекомендована література....................................................................................... | |
| Модуль 1. Основні поняття хімії та вчення про будову речовини............... | |
| Модуль 2. Закономірності перебігу хімічних процесів.................................... | |
| Лабораторна робота № 1. Визначення теплового ефекту реакції....................... | |
| Лабораторна робота № 2. ....................................................................................... Досліди до теми: Швидкість хімічних реакцій. Каталіз................................ Досліди до теми: Хімічна рівновага................................................................. | |
| Модуль 3. Розчини................................................................................................. | |
| Лабораторна робота № 3. ....................................................................................... Досліди до теми: Електролітична дисоціація .................................................................... Досліди до тем: Йонні реакції в розчинах електролітів. Добуток розчинності малорозчинних речовин..................................................................... Досліди до тем: Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів. Гідроліз солей ..................... Досліди до теми: Твердість води та способи її усунення.............................. | |
| Модуль 4. Окисно-відновні реакції та електрохімічні процеси.................... | |
| Лабораторна робота № 4. Окисно-відновні реакції.............................................. | |
| Лабораторна робота № 5. Гальванічні елементи................................................... | |
| Лабораторна робота № 6. Електроліз розчинів. Акумулятори ........................... | |
| Лабораторна робота № 7. Корозія металів. Методи захисту від корозії............. | |
| Модуль 5. Конструкційні матеріали................................................................ | |
| Лабораторна робота № 8 ......................................................................................... Досліди до теми: Легкі конструкційні метали (алюміній, магній, титан) ..... Досліди до теми: Конструкційні метали – залізо, кобальт, нікель ................ Досліди до теми: Конструкційні метали – мідь, хром .................................... | |
| Додатки ..................................................................................................................... |
Дата добавления: 2015-04-16; просмотров: 254; Мы поможем в написании вашей работы!; Нарушение авторских прав |