
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Министерство образования и науки Республики Казахстан. Опыт 5. Получение коллоидов методом диспергирования
Опыт 5. Получение коллоидов методом диспергирования.
Пептизация почвы раствором щелочи.
В два химических стакана помещают по 1 г почвы, в один стакан приливается 10 см3 0,1н NaOH, в другой стакан столько же дистиллированной воды. Растворы кипятят 3-5 минут, затем охлаждают и отфильтровывают в пробирки. При сравнении окрасок делают выводы об образовании при кипячении с NaOH золя Fe(OH)3. Напишите схему строения мицеллы полученного золя.
Опыт 6. Взаимная коагуляция золей.
При смешивании двух золей, частицы которых заряжены противоположно, может наступить взаимная коагуляция. Эта коагуляция лучше всего происходит при равенстве общего количества противоположных зарядов золей (возможна взаимная нейтрализация частиц), но может отсутствовать при значительном избытке одного из золей, так в этом случае происходит перезарядка частиц золя, взятого в меньшем количестве.
В шесть пробирок наливают указанные в табл. количества золей гидрата окиси железа и берлинской лазури. Содержимое пробирок перемешивают и через 10 мин. Отмечают интенсивность коагуляции золей в каждой пробирке. Результаты наблюдений заносят в табл. 6.8.
Таблица 6.8
| Реактивы, см3 | № пробирок | |||||
| Золь гидрата окиси железа | 4,0 | 3,5 | 3,0 | 2,5 | 2,0 | 1,5 |
| Золь берлинской лазури | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | 3,5 |
| Интенсивность коагуляции |
Опыт 7. Коагуляция коллоидов и проверка правила знака и зарядности.
По 5 см3 исследуемого золя, полученного согласно заданию в опыте 2 или опыте 4, наливают в 4 пробирки и по каплям, до помутнения, добавляют заранее приготовленные растворы:
а) для золя, полученного в опыте 2,:
в первую пробирку – K3[Fe(CN)6],
во вторую пробирку – Na 2SO4,
в третью пробирку – KCl;
Степень помутнения определяют в сравнении с контролем (4-я пробирка). Отмечают объемы электролитов, пошедших на коагуляцию. Данные заносят в табл. 6.9
Таблица 6.9 Данные для определения порога коагуляции
| №№ п/п | Электролит | W3, см3 | Сэл, кмоль/м3 | Vэл, см3 | γ, кмоль/м3 | Отношение |
| K3[Fe(CN)6] или Na3PO4 | γ3/γ1 = | |||||
| NaSO4 | γ3/γ2 = | |||||
| KCl | γ3/γ3 = 1 |
Порог коагуляции рассчитывают по формуле (6,23). Делением большого порога коагуляции на меньшее находят соотношение коагулирующей способности ионов различной степени окисления.
Сделайте вывод о справедливости правила Шульца-Гарди.
Опыт 8. Защитное действие желатина на золь Fe(ОН)3.
В две пробирки наливают по 5 см3 золя, полученного в опытах 2 или 4. В одну из них добавляют 1 см3 1%-ного раствора желатина и, затем, в обе — по 3-5 см3 0,1 н раствора К2SO4. Записывают в какой пробирке происходит коагуляция.
Сравнивают результаты и записывают наблюдения.
Опыт 9. Коагуляция желатина добавлением дегидратирующего вещества
В пять сухих пробирок приливают по 1 см3 буферных растворов со следующими значениями рН: 6,5; 5,3; 4,7; 4,1; 3,5. В каждую пробирку при перемешивании приливают по 0,3 см3 1%-ного раствора желатина, а затем поочередно добавляют по 1 см3 безводного этилового спирта.
Замечают и записывают очередность помутнения в каждой пробирке. Объясните, почему в пробирке с рН = 4,7 (ИЭТ желатина) помутнение начинается сразу, а при рН = 6,5 и рН = 3,5 помутнения не наблюдается. Сделайте выводы.
Опыт 10. Влияние рН среды на набухание ВМС (желатин).
В пять сухих мерных пробирок помещают по 0,4 г одинаково измельченного желатина. Объем (Vo), занятый желатином, записывают в табл. 6.10.
Таблица 6.10
Данные по определению степени набухания
| № п/п | рН | Vo, см3 | Vн, см3 | α |
| 3.5 | 0,36 | |||
| 4.1 | 0,36 | |||
| 4.7 | 0,36 | |||
| 5.3 | 0,36 | |||
| 6.5 | 0,36 |
В каждую пробирку приливают до отметки 6 см3 буферного раствора с различными значениями рН (3,5; 4,1; 4,7; 5,3; 6,5). Растворы периодически перемешивают, оставляют в штативе на 40-50 минут. Через указанное время измеряют объем набухшего желатина (Vн).
0,4 г желатина занимает объем ~ 0,70 см3. Рассчитывают степень набухания (α) по ур-нию (6.24) для различных значений рН.
Данные заносят в табл.6.10 и строят график зависимости рН = f (α). Делают вывод о влиянии рН (ИЭТ) на набухание
ПРИЛОЖЕНИЕ
Таблица 1 Универсальная газовая постоянная R
| Единица измерения | Сокращенное обозначение, размерность | Коэффициенты для приведения к единицам СИ |
| Джоуль на киломоль-градус |  (см2сек2град)
(см2сек2град)
| 0,082 
|
1,986 
| ||
8,32 * 107 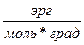
| ||
8,32 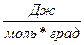
| ||
8,32 * 103 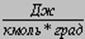
|
Таблица 2. Подвижность ионов при бесконечном разбавлении
раствора, См * м2/кмоль (291К)
| Ион | Подвижность | Температурный Коэффициент |
| Na+ | 43,6 | 0,0244 |
| K+ | 63,7 | 0,0217 |
| Cl+ | 66,3 | 0,0216 |
| OH - | 174,0 | 0,1800 |
| NH4 - | 63,6 | 0,0180 |
| CH3COO - | 35,0 | 0,0238 |
| H+ | 315,0 | 0,154 |
| Ag+ | 53,2 | 0,0229 |
| NO3 - | 62,6 | 0,0205 |
Таблица 3. Криоскопические и эбулиоскопические константы некоторых растворителей
| Растворитель | Формула | К, 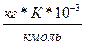
| Е, 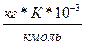
|
| Вода................................. | Н2О | 1,86 | 0,85 |
| Бензол............................. | С6Н6 | 5,12 | 2,57 |
| Уксусная кислота........... | СН3СООН | 3,90 | 3,10 |
Таблица 4 . Поверхностное натяжение воды при различных температурах
| Температура, К | Поверхностное натяжение, 10-3 Н/м | Температура, К | Поверхностное натяжение, 10-3 Н/м |
| 73,05 | 72,44 | ||
| 73,90 | 72,28 | ||
| 72,75 | 72,13 | ||
| 72,79 | 71,97 |
Таблица 5 . Константы диссоциации кислот и оснований при 293 К
| Вещество | Формула | Кд | рКд= - lgКд |
| Уксусная | СН3СООН | 1,85*10-6 | 4,75 |
| Фосфорная | Н3РО4 | 1. 7,52*10-3 | 2,12 |
| 2. 6,81*10-8 | 7,20 | ||
| 3. 1,26*10-12 | 11,9 | ||
| Аммоний гидроксид | NH4OH | 1,79*10-5 | 4,74 |
Таблица 6. Интегральная теплота растворения ΔН солей в воде при 298 К
| п, моль соли на 1 кг Н2О | ΔН, кДж/моль | ||||
| NaCl | KCl | KNO3 | CaCl2 | K2SO4 | |
| 1/ | 3,89 | 17,23 | 34,93 | -82,93 | 23,15 |
| 0,1 | 4,25 | 17,55 | 34,77 | -80,88 | 24,18 |
| 1,0 | 3,79 | 17,28 | - | -79,09 | - |
| 5,0 | 1,99 | - | - | - | - |
Таблица 8 . Метрическая система мер
Меры массы Меры объема
1 тонна = 1000 кг 1 м 3 = 1000дм 3 = 1 000 000см 3
1 центнер = 100 кг 1 дм 3 = 1 000 см 3
1 кг = 1 000 г 1 литр = 1 дм 3
1 грамм = 1 000 мг 1 гектолитр = 100 литрам
Таблица 7. Ионное произведение воды Кв = aн+ * аон_
при различной температуре_
| t, oC | Kв * 10-14 | t, oC | Kв * 10-14 | t, oC | Kв * 10-14 |
| 0, 4505 | 0,742 | 0,948 | |||
| 0,5702 | 0,802 | 1,008 | |||
| 0,6809 | 0,868 | 1,469 |
Таблица 8 . Метрическая система мер
Меры массы Меры объема
1 тонна = 1000 кг 1 м 3 = 1000дм 3 = 1 000 000см 3
1 центнер = 100 кг 1 дм 3 = 1 000 см 3
1 кг = 1 000 г 1 литр = 1 дм 3
1 грамм = 1 000 мг 1 гектолитр = 100 литрам
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсорбция 275
Адсорбция 275
— газов 283
— изотерма 279
— из растворов 287
— обменная 290
— отрицательная 288
— положительная 288
— специфическая 292
— удельная 276
— эквивалентная 290
Активаторы 127
Активность ионов 91
Актор 119
Акцептор 119
Аморфное состояние 19
Анизотропия 19
Аниониты 291
Антагонизм ионов 296
Антифризы 81
Ассоциация
— ионов 93
— молекул 21, 64
Безбуферный метод определения рН 179
Белки 269
— фибриллярные 270
— глобулярные 270
Броуновское движение 240
Буферная емкость 173
Буферные растворы 171
Буферный метод определения рН 179
Вещества
— поверхностно-активные 29
— поверхностно-неактивные 29
Вода
— диаграмма состояния 79
— ионное произведение 164
— полярность молекул 27, 63
— свободная 266
— связанная 266
Водородный показатель 165
Водородный электрод 192, 193
Второй закон термодинамики 48
Высокомолекулярные соединения (ВМС) 228, 231, 261
Вязкость жидкостей 29
Газы
— адсорбция 283
— идеальные 8
— кинетическая теория 12
— основные законы 8
— парциальное давление в смесях 17
— реальные 14
— уравнение состояния 11
Гальванический элемент 187
– – концентрационный 190
Гели 311
Гетерогенный катализ 128
Гидратация ионов 62
Гидролиз солей 168
Гомогенный катализ 127
Гранула 255
Давление
— диссоциации 153
— критическое 15
— набухания 265
— насыщенных паров 78
— осмотическое 75, 273
— парциальное 17
Двойной электрический слой 251
Денатурация 307
Дзета-потенциал 253
Диализ 234
Диализатор Грэма 234
Диссолюция 260
Дисперсиды 221
Дисперсионная среда 221
Дисперсная фаза 221
Дисперсность системы (степень дисперсности) 221
Дисперсоиды 221
Диффузионный потенциал 189
Диффузия 242
Диффузный слой 252
Диэлектрическая постоянная 64
Емкость поглощения почвы 319
Жидкости
— ассоциация 27, 64
— взаимная растворимость 51
— вязкость 29
— интермицеллярные 255, 271
— интрамицеллярные 271
— кристаллические 27
— ньютоновские 30
Загруженность окислительно — восстановительной системы 213
Закон(ы)
— Авогадро 10
— Бойля-Мариотта 8
— газовые 8
— Генри 67
— Гей-Люссака 9
— Гесса 45
— Дальтона 17
— действия масс 149
— Кольрауша 102
— Лавуазье и Лапласа 45
— Максвелла—Больцмана 123
— равновесия фаз 154
— разведения Оствальда 163
— Рауля 78, 79
— Фика 74, 242
Защитное действие растворов ВМС 309
Изобарный потенциал 58
Изобары идеального газа 10
Изоморфизм 23
Изотерма адсорбции 279
Изотропия 19
Инактивация 134
Ингибиторы 127
Индикаторы 176
Индикаторы универсальные 179
Индуктор 119
Ионная сила раствора 92
Ионообменные смолы 292
Каломельный электрод 193
Капиллярная конденсация 276
Катализ 126
— автокаталитические реакции 126
— микрогетерогенный 128
— отрицательный 126
— положительный 126
Катиониты 291
Коагуляция
— взаимная 296
— гидрофобных золей 296
— растворов ВМС 305
— скрытая 295
Коагуляция явная 295
Коацервация 327
Коллоиды
— лиофобные (гидрофобные) 228
— лиофильные (гидрофильные) 260
— необратимые 307
— обратимые 307
Кольца Лизеганга 317
Компонента 36
Константа
— Ван—дер—Ваальса 17
— гидролиза 170
— криоскопическая 71
— скорости химической реакции 112
— химического равновесия 141
— электролитической диссоциации 162
Коэффициент
— активности ионов 91
— вязкости 29
— диффузии газов 242
— изотонический 86
— полезного действия 51
— термического расширения 24
Кривая расслоения 69
Криоскопия 82
Кристаллические тела 19, 21
Критические давления 15
Лиотропные ряды 296
Максимальная работа (полезная) 158
Мицелла 255
Мультиплеты 131
Набухание гелей 312
Насыщенный пар 78
Нормальный
— водородный электрод 192, 193
— электродный потенциал 185
— элемент Вестона 200
Обратимые реакции 119
Объем критический 15
Опалесценция 237
Осмос 75
Осмотическое давление 76
Основной термодинамический цикл (цикл Карно) 49
Отвердевание 6
Парциальное давление 17
Парциальный объем 18
Пептизация золей 301
Первый закон термодинамики 38
Перезарядка золей 299
Плазма 7
Плазмолиз 77
Поверхностное натяжение 28
Подвижность ионов 102
Поликонденсация 232
Полимеризация 231
Полиморфизм 23
Полихромия золей 238
Порог коагуляции 295
Потенциалы
— диффузионные 189
— изобарные 58, 74
— мембранные 190
— окислительно — восстановительный 206
— протекания 250
— седиментации 250
— стандартные 185
— термодинамические 57, 58
— электродные 253
— электрокинетические 253
Правило
— Вальдена — Писаржевского 103
— Вант — Гоффа 121
— произведения растворимости 156
— Траубе — Дюкло 285
— фаз 154
— Шульце—Гарди 296
— Ле Шателье 150
— плотнейшей упаковки 20, 22
Промоторы 127
Простетическая группа 135
Равновесие Доннана 244
— седиментационное 246
— химическое 148
Рассеяние света 237
Растворы буферные 171
— гипертонические 77
— гипотонические 77
— идеальные 78
Растворы изотонические 77
— коллоидные 287
Реакции
— бимолекулярные 113
— второго порядка 116
— гетерогенные 136
— мономолекулярные 112
— параллельные 117
— первого порядка 113
— сложные 117
— сопряженные 118
— тримолекулярные 113
— цепные 118
— экзотермические 42
— эндотермические 42
Решетки кристаллические 21
Ряд напряжений 186
Свободная энергия 52, 74
Свойства систем 36
Связанная энергия 52
Седиментация 246
Сжижение 6
Синерезис гелей 317
Системы
— изолированные 36
— неизолированные 36
Скорость реакции
— — влияние температуры 121
— — зависимость от концентрации 113
— — истинная 111
— — константа 112
— — средняя 111
Сорбент 275
Сорбтив 275
Сорбция 275
Спайность 20
Сублимация 6
Текучесть 29
Температура термодинамическая 10
— замерзания 79
— кипения 31
Теория
— ансамблей 132
— газов, кинетическая 12
— гидратная 62
— мультиплетная 131
— сильных электролитов 90
Теория электролитической диссоциации 86
Тепловая теорема Нернста 58
Тепловой эффект реакции 42
Теплота
— гидратации 66
— испарения 31
— нейтрализации 44
— образования 42
— парообразования 6
— плавления 6
— приведенная 52
— разложения 42
— растворения 42
— сгорания 44
— смачивания 289
— сублимации 6
Тиксотропия 304
Титрование
— высокочастотное 108
— кондуктометрическое 108
— потенциометрическое 214
Удельная поверхность 221
Удельная электрическая проводимость 95
Ультрамикроскопия 239
Ультрафильтрация 235
Ультрацентрифугирование 236
Универсальная газовая постоянная 11
Уравнение
— Аррениуса 101
— Ван-дер-Ваальса 17
— Гиббса 285
— Ленгмюра 282
— Нернста 185
— Никольского 292
— Рэлея 238
— состояния идеального газа 11
— Фрейндлиха 281
— IIIишковского 285
Устойчивость золей
— — агрегативная 260
— — кинетическая 259
Фаза 36
— простая 153
— смешанная 153
Ферменты 132
Флотация 290
Флуктуация 8
Хемосорбция 276
Химическая индукция 119
Химическая кинетика 111
Цепи
— водородные 203
— двойные хингидропные 204
— каломельно — водородная 203
— каломельно — стеклянная 205
— концентрационная 190
— хингидронно — каломельная 204
Цикл Карно 49
Число
— Авогадро 10
— железное 309
— золотое 309
— рубиновое 309
— степеней свободы 154
— Фарадея 127
Шульце — Гарди правило 296
Эбулиоскопическая постоянная 81
Электродиализ 235
Электрод
— водородный 192
— каломельный 193
— стеклянный 197
— хингидронный 196
— хлорсеребряный 195
— электролиз 215
Электроосмос 249
Электрическая проводимость
— — при бесконечном разбавлении 98
— — удельная 95
— — эквивалентная 98
Электрофорез 249
Элемент
— нормальный (Вестона) 200
— Якоби—Даниеля 187
Энергия
— активации 123
— внутренняя 37
— гидратации 66
— свободная 52
— связанная 52
Энтропия 53
Эффект
— протекания 250
— седиментации 246
— тепловой 43
— Фарадея—Тиндаля 237
Ядро коллоидной мицеллы 255
Министерство образования и науки Республики Казахстан
Дата добавления: 2014-11-13; просмотров: 242; Мы поможем в написании вашей работы!; Нарушение авторских прав |