
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа 1. Основные классы неорганических соединений
Основные классы неорганических соединений
Цель работы: изучить классы неорганических соединений, научиться составлять уравнения реакций.
Задание: провести опыты по получению основного и кислотного оксидов, основания, кислоты, основной соли, определить их химические свойства. Выполнить требования к результатам опытов, оформить отчет, решить задачу.
Теоретическое введение
Все вещества делятся на простые и сложные. Сложные вещества подразделяются на классы: оксиды, кислоты, основания, соли.
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. По химическим свойствам оксиды делятся на основные, кислотные и амфотерные (табл. 1.1).
Таблица 1.1
Химические свойства оксидов
| Взаимодействие оксидов | Оксиды | ||
| Основные Na2O, CaO, MgO, CuO, Fe2O3, ВаО | Кислотные SO2, SO3, P2O5, CO2, Cl2O, Mn2O7, CrO3 | Амфотерные ВеО, ZnO, PbO, MnO2, SnO, Al2O3, Cr2O3 | |
| С водой | Реагируют только оксиды щелочных и щелочноземельных металлов, образуя щелочи: Na2O + H2O = 2NaOH | Образуют кислоты: SO3 + H2O = H2SO4 | Не взаимодействуют |
| С кислотами или основаниями | Взаимодействуют с кислотами с образованием соли и воды: CаO + 2HCl = = CаCl2 + H2O | Взаимодействуют с основаниями с образованием соли и воды: CO2 + Ba(OH)2 = = BaCO3 + H2O | Взаимодействуют с кислотамикак основные оксиды: BeO + 2HNO3 = Be(NO3)2 + H2O
и с основаниями
как кислотные оксиды: BeO + 2KOH 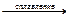 K2BeO2 + H2O;
BeO + 2KOH + H2O = K2[Be(OН)4] K2BeO2 + H2O;
BeO + 2KOH + H2O = K2[Be(OН)4]
|
| Между собой | При взаимодействии основного и кислотного оксидов образуется соль: Na2O + SO3 = Na2SO4 |
Одним из способов получения оксидов является взаимодействие простых веществ с кислородом: 2Са + O2 = 2СаO; С + O2 = СО2.
Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка (HNO3, HCl, H2SO4, Н3РО4).
Кислоты взаимодействуют
1. С основаниями с образованием соли и воды:
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O.
2. С основными и амфотерными оксидами с образованием соли и воды:
2HCl + ВаO = ВаCl2 + H2O;
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O.
3. С солями с образованием новой соли и новой кислоты:
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3.
Одним из способов получения кислот является взаимодействие кислотного оксида с водой:
P2O5 + 3H2O = 2H3PO4.
Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами (NaOH, Cu(OH)2, Fe(OH)3).
Основания взаимодействуют
1. С кислотами с образованием соли и воды:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
2. С кислотными и амфотерными оксидами с образованием соли и воды:
2KOH + N2O5 = 2KNO3 + H2O;
2NaOH + Al2O3 + 3Н2О = 2Na[Al(OH)4];
2NaOH + Al2O3 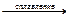 2NaAlO2 + H2O.
2NaAlO2 + H2O.
3. С солями с образованием новой соли и нового основания:
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl.
Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой:
2Na + 2H2O = 2NaOH + H2↑;
BaO + H2O = Ba(OH)2.
Нерастворимые в воде основания получают реакцией обмена:
Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4.
Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками.
Средние соли (К2SO4, Na3PO4) – это продукты полного замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотные остататки: H2SO4 + 2KOH = K2SO4 + 2H2O;
Mg(ОН)2 + 2HCl = MgCl2 + 2Н2О.
Кислые соли (Сa(HCO3)2, Nа2НРО4) – это продукты неполного замещения водорода в кислоте на металл:
KOH + H2SO4 = KHSO4 + H2O.
Кислые соли образуют только многоосновные кислоты, например H2SO4, Н3РО4, Н2СО3, H2S.
Основные соли (СuOHNO3, AlOHCl2) – это продукты неполного замещения гидроксогрупп в основании на кислотные остатки:
Fe(ОН)3 + HNO3 = Fe(OH)2NO3 + 2Н2О;
Fe(ОН)3 + 2HNO3 = FeOH(NO3)2 + 2Н2О.
Основные соли образуют только многокислотные основания, например Сu(OH)2, Fe(OH)3, Mg(ОН)2.
Дата добавления: 2014-11-13; просмотров: 352; Мы поможем в написании вашей работы!; Нарушение авторских прав |