
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи и упражнения для самостоятельного решения. 21.1. Как получить сульфат марганца (II) из: а) оксида марганца (II);
21.1. Как получить сульфат марганца (II) из: а) оксида марганца (II);
б) металлического марганца; в) KMnO4? Составить соответствующие уравнения реакций.
21.2. Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4 в кислой среде? (Ответ: 1,58 г).
21.3. Рассчитать молярную массу эквивалентов перманганата калия в реакции
KMnO4 + PH3 + H2SO4 = H3PO4 + ….
Какая масса H3PO4 образуется, если в реакции участвовало 17 г PH3?
(Ответ: 31,6 г/моль; 49 г).
21.4. Под действием HNO3 манганаты диспропорционируют следующим образом: 3K2MnO4 + 4HNO3 = 2KMnO4 + MnO2 + 4KNO3 + 2H2O.
Какой объем раствора HNO3 (ρ = 1,185 г/мл) с массовой долей 30 % необходим для получения 9,48 г перманганата калия? (Ответ: 21,3 мл).
21.5. Как получить соединения марганца (VI) из соединений с более высокой и с более низкой степенью окисления? Составить соответствующие уравнения реакций.
21.6. Окисление сульфата железа (II) перманганатом калия в нейтральной среде протекает по уравнению KMnO4 + FeSO4 + Н2О = FeОНSO4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 2,63 г).
21.7. Закончить уравнения реакций: а) MnO + H2SO4 = …;
б) Mn2O7 + KOH = …; в) MnSO4 + KClO3 + KOH 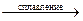 K2MnO4 + ….
K2MnO4 + ….
21.8. Закончить уравнения реакций, в которых соединения марганца проявляют свойства: а) окислительные Fe(OH)2 + KMnO4 + H2O = …;
б) восстановительные MnSO4 + PbO2 + HNO3 = …;
в) окислительные и восстановительные одновременно K2MnO4 + H2O = ….
21.9. Почему оксид марганца (IV) может проявлять и окислительные и восстановительные свойства? Закончить уравнения реакций:
а) MnO2 + KI + H2SO4 = …; б) MnO2 + KNO3 + KOH = ….
21.10. Как меняется степень окисления марганца при восстановлении KMnO4 в кислой, щелочной и нейтральной среде? Закончить уравнения реакций:
а) KMnO4 + К2SO3 + H2SO4 = …;
б) KMnO4 + К2SO3 + КОН = …; в) KMnO4 + К2SO3 + H2O = ….
21.11. Восстановление перманганата калия сульфатом железа (II) в кислой среде протекает по уравнению KMnO4 + FeSO4 + H2SO4 =…. На восстановление KMnO4 израсходовано 47 мл 0,208 н. раствора FeSO4. Какая масса KMnO4 содержалось в исходном растворе? (Ответ: 0,154 г).
21.12. Закончить уравнения реакций: а) Mn + H2SO4 (разб.) = …;
б) MnCl2 + KOH = …; в) MnCl2 + H2O ↔ …; г) Mn + HNO3 (разб.) = ….
21.13. Окисление сульфата железа (II) перманганатом калия в щелочной среде протекает по уравнению KMnO4 + FeSO4 + КОН = FeОНSO4 + ….
Какая масса перманганата калия потребуется для окисления 7,6 г FeSO4?
(Ответ: 7,9 г).
21.14. Можно ли восстановить марганец из его оксида алюминием? Ответ мотивировать, вычислив ΔG° реакции 3MnO2 + 4Al = 2Al2O3 + 3Mn.
(  = –464,8 кДж/моль;
= –464,8 кДж/моль; 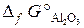 = –1582 кДж/моль).
= –1582 кДж/моль).
21.15. Как можно перевести в растворимое состояние марганец? Составить соответствующие уравнения реакций.
21.16. Вычислить молярную массу эквивалентов и эквивалент окислителя в реакции NaNO2 + KMnO4 + H2SO4 = ….
21.17. По стандартным энтальпиям образования вычислить тепловой эффект реакции получения марганца 3MnO2 + 4Al = 2Al2O3 + 3Mn.
( 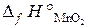 = –519,4 кДж/моль;
= –519,4 кДж/моль; 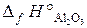 = –1676 кДж/моль).
= –1676 кДж/моль).
(Ответ: −1793,8 кДж).
21.18. Закончить уравнения реакций: а) KMnO4 + H2SO4 (конц.) = …;
б) Mn2O7 + HCl = …; в) Mn2O7 + NaOH = …; г) MnO2 + KOH = ….
21.19. За 10 мин из раствора MnSO4 ток силой 5 А выделил 0,85 г Mn. Определить молярную массу эквивалентов марганца. (Ответ: 27,3 г/моль).
21.20. Закончить уравнения реакций: а) K2MnO4 + Cl2 = …;
б) Mn(NO3)2 + H2O ↔ …; в) MnSO4 + H2O ↔ …; г) MnCl2 + NaOH = ….
Реакции б), в), г) написать в молекулярном и ионно-молекулярном виде.
Дата добавления: 2014-11-13; просмотров: 342; Мы поможем в написании вашей работы!; Нарушение авторских прав |