
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Продукты сгорания топлива, определение их объемов
Горение представляет реакцию соединения горючих элементов топлива (углерода, водорода, серы) с окислителем – кислородом воздуха. В основном сгорание топлива происходит в парогазовом состоянии. Даже твёрдое топливо вначале в значительной мере газифицируется и затем сгорает.
Процесс окисления исходных веществ до образования конечных продуктов сгорания проходит через ряд промежуточных стадий, связанных в цепь последовательных быстротекущих реакций. Цепочки реакций лавинообразно разветвляются и за короткое время охватывают весь объём готовой горючей смеси. Отдельные цепи реакций, попав в неблагоприятные условия (нехватка кислорода, низкая температура у поверхности) могут обрываться. Таким образом, кроме окончательных соединений в составе продуктов сгорания оказываются и промежуточные.
 Полный объем продуктов сгорания представляет собой сумму объемов сухих газов и водяных паров, м3/кг:
Полный объем продуктов сгорания представляет собой сумму объемов сухих газов и водяных паров, м3/кг:
Объем сухих газов принимают за 100%. При полном сгорании топлива состав сухих продуктов сгорания составляет:
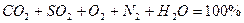 |
 Объем сухих газов представляет собой сумму:
Объем сухих газов представляет собой сумму:
Газообразные продукты сгорания состоят из трехатомных газов CO2 и SO2 , сумму которых принято обозначать RO2, и двухатомных газов – кислорода О2 и азота N2.
Тогда равенство при полном сгорании топлива имеет вид:
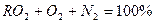
 Объем сухих газов в общем виде составляет:
Объем сухих газов в общем виде составляет:
Для твердых и жидких топлив теоретические объемы (м3/кг) продуктов полного сгорания определяются по формулам.
Объем двухатомных газов:
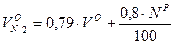 |
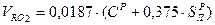 Объем трехатомных газов:
Объем трехатомных газов:
Расход кислорода на горение углерода и серы иногда рассчитывают суммарно, исходя из содержания (условного) углерода:
 | ||||
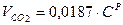 | ||||
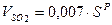 | ||||
 |
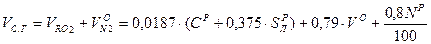 Исходя из выше изложенного, объем сухих газов составляет:
Исходя из выше изложенного, объем сухих газов составляет:
Объем водяных паров составляет:
 |
При сжигании твердого топлива приходится считаться с тем, что не весь углерод переходит в продукты сгорания.
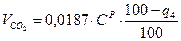 Потери вследствие механической неполноты сгорания:
Потери вследствие механической неполноты сгорания:
Для газообразного топлива теоретические объемы продуктов сгорания (м3/м3) определяются по формулам.
 Полный объем продуктов сгорания:
Полный объем продуктов сгорания:
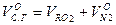 Объем сухих газов составляет:
Объем сухих газов составляет:
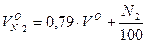 Объем двухатомных газов:
Объем двухатомных газов:
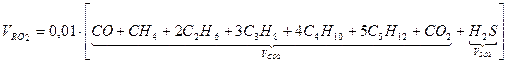 Объем трехатомных газов:
Объем трехатомных газов:
Объем водяных паров:
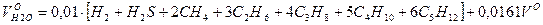 | |||
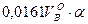 |
Для действительного объема , где a - коэффициент избытка воздуха.
Количество кислорода, теоретически необходимое для сжигания 1м3 топлива:

Расчет объемов продуктов сгорания твердого, жидкого и газообразного топлива приведены так же в таблице 1.4.
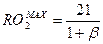 Максимальное содержание (%) трехатомных газов обозначается RO2max и при полном сгорании топлива определяется:
Максимальное содержание (%) трехатомных газов обозначается RO2max и при полном сгорании топлива определяется:
где b – характеристика топлива – показывает отношение расхода кислорода воздуха на окисление свободного водорода топлива к расходу кислорода на образование трехатомных газов.
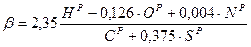 Для твердого топлива:
Для твердого топлива:
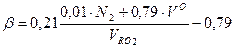 Для газообразного топлива:
Для газообразного топлива:
Содержание (%) СО2, SO2, RO2 и N2 сухих газах при полном сгорании топлива определяется по формулам:
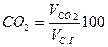 | 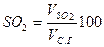 | 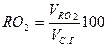 | 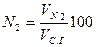 |
; ; ; .
Основное уравнение полного горения имеет вид:

Таблица 1.4 – Теоретические объёмы воздуха и продуктов сгорания (м3/кг или м3/м3)
| Объём | Топливо | Расчётная формула |
| Теоретический воздуха | Твердое и жидкое | Vв0=0,0889(Ср+0,375Sp)+0,265НЗ-0,0333 Ор 
|
| Газовое | Vв0=0,0476[2СН4+0,5СО+0,5Н2+
+  СmHn-O2] СmHn-O2]
| |
| Трёхатомных сухих газов | Твёрдое и жидкое | VRO2=0,01866 (Cp+0,375 Sp) |
| Газовое | VRO2=0,01 (СН4+СО+СО2+∑mCmHn) | |
| Водяных паров | Твёрдое и жидкое | V0H2O=0,111Нр+0,0124Wp+0,0161 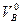
|
| Газовое | V0H2O=0,01(2СН4+Н2+ 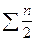 СmHn+0,124dr)+
+0,0161V0в СmHn+0,124dr)+
+0,0161V0в
| |
| Азота | Твёрдое и жидкое | 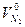 =0,79 =0,79 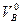 +0,008Np +0,008Np
|
| Газовое | 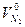 =0,79 =0,79 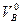 +0,01N2 +0,01N2
|
Примечание: dr – влагосодержание газа, г/кг.
Дата добавления: 2014-12-03; просмотров: 642; Мы поможем в написании вашей работы!; Нарушение авторских прав |