
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость химической реакции горения, и ее зависимость от различных факторов
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимают массовое количество вещества, реагирующее в единице объема в единицу времени.
Скорость гетерогенной реакции выражают количеством вещества, реагирующего на поверхности твердого горючего.
В области I (рисунок 1.6) при рассматриваемой температуре скорость химической реакции ниже скорости смесеобразования и результирующая скорость горения определяется скоростью химической реакции. Кинетическое горение наблюдается при низких температурах в зоне горения. При высоких температурах оно может протекать при очень интенсивном смесеобразовании.
В области III скорость смесеобразования, определяемая линиями 2 меньше скорости химической реакции. Диффузионное горение наблюдается при высоких температурах в зоне горения. При медленном смесеобразовании оно возможно и при  низких температурах.
низких температурах.
Рисунок 1.6 – Зависимость скорости горения и смесеобразования от температуры
Горение при условии, когда скорость химической реакции и скорость смесеобразования равны, называется промежуточным (II область).
Скорость протекания химических реакций и положение равновесия зависит от химической природы реагирующих веществ, концентрации реагирующих веществ и физических условий (температуры, давления).
В однородной среде при Т=const скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
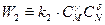

где k – константа скорости реакции, зависящая от температуры и химической природы, реагирующих веществ; СА, CB, CM, CN – текущие концентрации реагирующих веществ, моль/м3; a, b, g, d - стехиометрические коэффициенты, показывающие число молей веществ, участвующих в реакции.
В условии гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
Wp= k Cпо2,
где Cпо2 –концентрации кислорода у поверхности топлива.
 Химическое равновесие описывается уравнением:
Химическое равновесие описывается уравнением:
Константа равновесия определяется из уравнения:
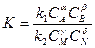 |

В условиях промышленного сжигания топлива обычно состояние равновесия не наступает. Скорость реакции можно определить по скорости превращения любого из реагентов, поэтому скорость сгорания топлива можно выразить через скорость расходования горючих элементов или топлива в целом, а также через скорость расходования окислителя или скорость образования продуктов сгорания.
Дата добавления: 2014-12-03; просмотров: 435; Мы поможем в написании вашей работы!; Нарушение авторских прав |