
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Перший закон термодинаміки
На рис. 2.13 умовно зображені енергетичні потоки між виділеною термодинамічною системою і навколишніми тілами. Величина Q > 0, якщо тепловий потік спрямований убік термодинамічної системи. Величина A > 0, якщо термодинамічна система виконує позитивну роботу над навколишніми тілами.

Рис.2.13
Якщо система обмінюється теплом із навколишніми тілами і виконує роботу (позитивну або негативну), то змінюється стан системи, тобто змінюються її макроскопічні параметри (температура, тиск, об’єм). Оскільки внутрішня енергія U однозначно визначається макроскопічними параметрами, що характеризують стан системи, то звідси випливає, що процеси теплообміну й виконання роботи супроводжуються зміною ΔU внутрішньої енергії системи.
Перший закон термодинаміки є узагальненням закону збереження й перетворення енергії для термодинамічної системи. Він формулюється так:
Зміна ΔU внутрішньої енергії неізольованої термодинамічної системи дорівнює різниці між кількістю теплоти Q, переданій системі, і роботою A, виконаною системою над зовнішніми тілами
ΔU = Q – A. (2.4.4)
Співвідношення, що виражає перший закон термодинаміки, часто записують в іншій формі:
Q = ΔU + A. (2.4.5)
Теплота, отримана системою, йде на зміну її внутрішньої енергії і на виконання роботи системою над зовнішніми тілами.
Перший закон термодинаміки є узагальненням дослідних фактів. Відповідно до цього закону, енергія не може бути створена або знищена; вона передається від однієї системи до іншої і перетворюється з однієї форми в іншу. Важливим наслідком першого закону термодинаміки є твердження про неможливість створення машини, здатної виконувати корисну роботу без споживання енергії ззовні і без яких-небудь змін усередині самої машини. Така гіпотетична машина одержала назву вічного двигуна 1-го роду. Численні спроби побудувати таку машину незмінно закінчувалися провалом. Будь-яка машина може виконувати позитивну роботу A над зовнішніми тілами тільки за рахунок одержання деякої кількості теплоти Q від навколишніх тіл або зменшення ΔU своєї внутрішньої енергії.
Застосуємо перший закон термодинаміки до ізопроцесів у газах. В ізохоричному процесі (V = const) газ роботи не виконує: A = 0. Отже,
dQ = dU =  . (2.4.6)
. (2.4.6)
Внутрішня енергія ідеального газу залежить тільки від температури. При ізохорному нагріванні тепло поглинається газом (Q > 0), і його внутрішня енергія збільшується. При охолодженні тепло віддається зовнішнім тілам (Q < 0).
В ізобаричному процесі (p = const) робота, виконана газом, виражається співвідношенням
A = p(V2 – V1) = pΔV. (2.4.7)
Перший закон термодинаміки для ізобаричного процесу дає:
dQ =  + pdV. (2.4.8)
+ pdV. (2.4.8)
При ізобаричному розширенні Q > 0 – тепло поглинається газом, і газ виконує позитивну роботу. При ізобаричному стисненні Q < 0 – тепло віддається зовнішнім тілам. У цьому випадку A < 0. Температура газу при ізобаричному стисненні зменшується: T2 < T1; внутрішня енергія зменшується: dU < 0.
В ізотермічному процесітемпература газу не змінюється, отже, не змінюється і внутрішня енергія газу: dU = 0.
Перший закон термодинаміки для ізотермічного процесу виражається співвідношенням:
dQ = dA=pdV. (2.4.9)
Кількість теплоти dQ, отриманої газом у процесі ізотермічного розширення, перетворюється у роботу над зовнішніми тілами. При ізотермічному стисненні робота зовнішніх сил, виконана над газом, перетворюється у тепло, яке передається навколишнім тілам.
Поряд з ізохоричним, ізобаричним і ізотермічним процесами в термодинаміці часто розглядаються процеси, які протікають при відсутності теплообміну з навколишніми тілами. Посудина з теплонепроникними стінками має назву адіабатичної оболонки, а процеси розширення або стиснення газу в таких посудинах називаються адіабатичними.
В адіабатичному процесі dQ= 0; тому перший закон термодинаміки набуває вигляду:
A = –dU, (2.4.10)
тобто газ виконує роботу за рахунок зменшення його внутрішньої енергії.
На площині (p, V) процес адіабатичного розширення (або стиснення) газу зображується кривою, яка називається адіабатою. При адіабатичному розширенні газ виконує позитивну роботу (A > 0); тому його внутрішня енергія зменшується (dU < 0). Це приводить до зниження температури газу. Унаслідок цього тиск газу при адіабатичному розширенні зменшується швидше, ніж при ізотермічному розширенні (рис. 2.14).

Рис. 2.14
У термодинаміці виводиться рівняння адіабатичного процесу для ідеального газу. У координатах (p, V) це рівняння має вигляд:
pVγ = const. (2.4.11)
Це співвідношення називають рівнянням Пуассона. Тут γ = Cp / CV – показник адіабати, Cp і CV – теплоємності газу в процесах з постійним тиском і з постійним об’ємом. Для одноатомного газу γ =  (в цьому випадку і=3); для двохатомного газу
(в цьому випадку і=3); для двохатомного газу  , (в цьому випадку і=5); для багатоатомного газу γ=1,33 ( і=6).
, (в цьому випадку і=5); для багатоатомного газу γ=1,33 ( і=6).
Робота газу в адіабатичному процесі просто виражається через температури T1 і T2 початкового й кінцевого станів:
A = CV(T2 – T1). (2.4.12)
Адіабатичний процес також можна віднести до ізопроцесів. У термодинаміці важливу роль відіграє фізична величина, яка називається ентропією. Зміна ентропії у будь-якому квазістатичному процесі дорівнює приведеному теплу dQ / T, отриманому системою. Оскільки на будь-якій ділянці адіабатичного процесу dQ = 0, ентропія в цьому процесі залишається незмінною.
Адіабатичний процес (так само, як і інші ізопроцеси) є процесом квазістатичним. Усі проміжні стани газу в цьому процесі близькі до станів термодинамічної рівноваги. Будь-яка точка на адіабаті описує рівноважний стан.
Не всякий процес, проведений в адіабатичній оболонці, тобто без теплообміну з навколишніми тілами, задовольняє цю умову. Прикладом не квазістатичного процесу, у якому проміжні стани не рівноважні, може служити розширення газу в пустоту. На рис. 2.15 зображена тверда адіабатична оболонка, яка складається з двох сполучених посудин, поділених на частини краном K. У початковому стані газ заповнює одну з посудин, а в іншій посудині – вакуум. Після відкривання крану газ розширюється, заповнюючи обидві посудини, і встановлюється новий рівноважний стан. У цьому процесі Q = 0, тому що немає теплообміну з навколишніми тілами, і A = 0, тому що оболонка не деформується.
З першого закону термодинаміки випливає: dU = 0, тобто внутрішня енергія газу залишилася незмінною. Оскільки внутрішня енергія ідеального газу залежить лише від температури, температури газу в початковому й кінцевому станах однакові – точки на площині (p, V), що зображують ці стани, лежать на одній ізотермі. Усі проміжні стани газу не рівноважні і їх не можна зобразити на діаграмі.
Розширення газу в пустоту – приклад незворотного процесу. Його не можна провести в протилежному напрямку.
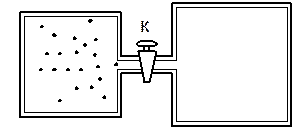
Рис. 2.15
Дата добавления: 2014-12-03; просмотров: 1055; Мы поможем в написании вашей работы!; Нарушение авторских прав |