
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплоємність ідеального газу
Якщо в результаті теплообміну тілу передається деяка кількість теплоти, то внутрішня енергія тіла і його температура змінюються. Кількість теплоти Q, необхідна для нагрівання 1 кг речовини на 1 К називають питомою теплоємністю речовини c
c = Q / (mdT). (2.4.12)
У багатьох випадках зручно використовувати молярну теплоємність газу С
C = μ · c, (2.4.13)
де μ – молярна маса речовини.
Визначена в такий спосіб теплоємність не є однозначною характеристикою речовини. Відповідно до першого закону термодинаміки зміна внутрішньої енергії тіла залежить не тільки від отриманої кількості теплоти, але і від роботи, виконаної тілом. У залежності від умов, при яких здійснювався процес теплопередачі, тіло могло виконувати різну роботу. Тому однакова кількість теплоти, передана тілу, могла викликати різні зміни його внутрішньої енергії і, отже, температури.
Така неоднозначність визначення теплоємності характерна тільки для газоподібної речовини. При нагріванні рідких і твердих тіл їх об’єм практично не змінюється, і робота розширення виявляється рівною нулю. Тому вся кількість теплоти, отримана тілом, йде на зміну його внутрішньої енергії. На відміну від рідин і твердих тіл газ у процесі теплопередачі може сильно змінювати свій об’єм і виконувати роботу. Тому теплоємність газоподібної речовини залежить від характеру термодинамічного процесу. Звичайно, розглядаються два значення теплоємності газів: CV – молярна теплоємність в ізохоричному процесі (V = const) і Cp – молярна теплоємність в ізобаричному процесі (p = const).
У процесі при постійному об’ємі газ роботи не виконує: A = 0. У цьому випадку з першого закону термодинаміки для 1 моля газу одержуємо
dQV = CVdT = dU. (2.4.14)
Зміна dU внутрішньої енергії газу прямо пропорційна зміні dT його температури.
Для процесу при постійному тиску перший закон термодинаміки дає:
dQp = dU + pΔV = CVdT + pdV, (2.4.15)
де dV – зміна об’єму 1-го моля ідеального газу при зміні його температури на dT. Звідси випливає:
Cp = Cv +  , (2.4.16)
, (2.4.16)
де dQp /dT = Cp – теплоємність ідеального газу при сталому тиску; Cv –теплоємність ідеального газу при сталому об’ємі.
Відношення dV / dT може бути знайдене з рівняння стану ідеального газу, записаного для 1-го моля:
pV = RT,
де R – газова стала.
Cпіввідношення, що виражає зв'язок між молярними теплоємностями Cp і CV, має вигляд (формула Майєра):
Cp = CV + R. (2.4.17)
Молярна теплоємність Cp газу в процесі з постійним тиском завжди більша молярної теплоємності CV у процесі з постійним об’ємом.
Відношення теплоємностей у процесах із постійним тиском і постійним об’ємом відіграє важливу роль у термодинаміці. Воно позначається грецькою буквою γ.
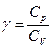 . (2.4.18)
. (2.4.18)
Зокрема, це відношення входить у формулу для адіабатичного процесу.
Слід зазначити, що «теплоємність», як і «кількість теплоти» – украй невдалі терміни. Вони дісталися сучасній фізиці в спадщину від теорії теплороду, яка панувала в XVIII сторіччі. Ця теорія розглядала теплоту як особливу невагому речовину, яка міститься в тілах. Вона не може бути ні створена, ні знищена. Нагрівання зводилось до збільшення, а охолодження – до зменшення кількості теплороду в тілах. Теорія теплороду не може пояснити, чому одну і ту ж зміну внутрішньої енергії тіла можна одержати, передаючи йому різну кількість теплоти в залежності від роботи, яку виконує тіло. Тому позбавлене фізичного змісту твердження, що “у даному тілі міститься певний запас теплоти”.
Середнє значення внутрішньої енергії 1-го моля ідеального газу дорівнює добутку середньої енергії однієї молекули  на число Авогадро NA:
на число Авогадро NA:
 (2.4.19)
(2.4.19)
При зміні температури на dT внутрішня енергія змінюється на величину
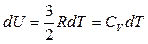 . (2.4.20)
. (2.4.20)
Коефіцієнт пропорційності між dU і dT дорівнює теплоємності CV при постійному об’ємі
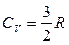 . (2.4.21)
. (2.4.21)
Це співвідношення добре підтверджується в експериментах з газами, які складаються з одноатомних молекул (гелій, неон, аргон). Однак, для двохатомних (водень, азот) і багатоатомних (вуглекислий газ і інші) це співвідношення не збігається з експериментальними даними. Причина такої розбіжності полягає в тому, що для двох і багатоатомних молекул середня кінетична енергія повинна включати не тільки енергію поступального руху, але й енергію обертального руху молекул.
На рис. 2.16 зображена модель двохатомної молекули. Молекула може виконувати п'ять незалежних рухів: три поступальних рухи уздовж осей X, Y, Z і два обертання відносно осей X і Y. Дослід показує, що обертання відносно осі Z, на якій лежать центри обох атомів, може бути врахованим тільки при дуже високих температурах.

Рис. 2.16
При звичайних температурах обертання біля осі Z не відбувається, так само як не обертається одноатомна молекула. Кожен незалежний рух називається ступенем вільності. Таким чином, одноатомна молекула має 3 поступальні ступені вільності, «тверда» двохатомна молекула має 5 ступенів (3 поступальні і 2 обертальні), а багатоатомна молекула – 6 ступенів вільності (3 поступальні і 3 обертальні).
У класичній статистичній фізиці виводиться теорема про рівномірний розподіл енергії за ступенями вільності:
Якщо система молекул знаходиться в тепловій рівновазі при температурі T, то середня кінетична енергія рівномірно розподілена між усіма ступенями вільності і для кожного ступеня вільності молекули вона дорівнює
Еі = 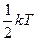 . (2.4.22)
. (2.4.22)
З цієї теореми випливає, що молярні теплоємності газу Cp і CV, які зв’язані рівнянням Майора (2.4.17), і їх відношення γ можуть бути записані у вигляді:

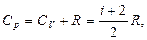
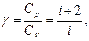 (2.4.23)
(2.4.23)
де i – число ступенів вільності газу.
Для газу, який складається з одноатомних молекул (i = 3)
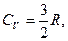
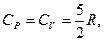
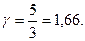 (2.4.24)
(2.4.24)
Для газу, який складається з двохатомних молекул (i=5)
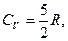

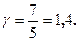 (2.4.25)
(2.4.25)
Для газу, який складається з багатоатомних молекул (i=6)
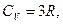
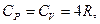
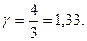 (2.4.26)
(2.4.26)
Експериментально виміряні теплоємності багатьох газів при звичайних умовах досить добре погоджуються з наведеними висновками. Однак, у цілому класична теорія теплоємності газів не може вважатися цілком задовільною. Існує багато прикладів значних розбіжностей між теорією й експериментом. Це пояснюється тим, що класична теорія не в змозі цілком врахувати енергію, пов'язану з внутрішніми рухами у молекулі.
Теорему про рівномірний розподіл енергії за ступенями вільності можна застосувати і до теплового руху частинок у твердому тілі. Атоми, що входять до складу кристалічних ґраток, виконують коливання біля положень рівноваги. Енергія цих коливань є внутрішньою енергію твердого тіла. Кожен атом у кристалічних ґратках може коливатися у трьох взаємно перпендикулярних напрямках. Отже, кожен атом має 3 коливальні ступені.
При гармонічних коливаннях середня кінетична енергія дорівнює середній потенціальній енергії. Тому відповідно до теореми про рівномірний розподіл на кожну коливальну ступень вільності приходиться середня енергія kT, а на один атом – 3kT. Внутрішня енергія 1 моля твердої речовини дорівнює:
U = 3NAkT = 3RT. (2.4.27)
Тому молярна теплоємність речовини у твердому стані дорівнює:
C = 3R = 25,12 Дж/моль·К.
Це співвідношення називається законом Дюлонга – Пті. Для твердих тіл практично не існує розходження між Cp і CV через мізерно малу роботу при розширенні або стисненні.
Дослід показує, що в багатьох твердих тілах (хімічних елементах) молярна теплоємність при звичайних температурах дійсно близька до 3R. Однак, при низьких температурах спостерігаються значні розбіжності між теорією й експериментом. Це показує, що гіпотеза про рівномірний розподіл енергії за ступенями вільності є наближенням.
Дослідна залежність теплоємності твердих тіл від температури буде пояснена пізніше на основі квантових уявлень.
Дата добавления: 2014-12-03; просмотров: 1564; Мы поможем в написании вашей работы!; Нарушение авторских прав |