
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Ядерна модель атома. Борівський воднеподібний атом. Спектральні серії
 7.1.1. Оскільки світло випромінюється і поглинається атомами речовини, то виникає питання: яка структура атомів забезпечує дискретний (квантовий) характер вказаних процесів? Вперше конструктивну відповідь на це питання дав Резерфорд (1911р), досліджуючи розсіяння
7.1.1. Оскільки світло випромінюється і поглинається атомами речовини, то виникає питання: яка структура атомів забезпечує дискретний (квантовий) характер вказаних процесів? Вперше конструктивну відповідь на це питання дав Резерфорд (1911р), досліджуючи розсіяння 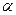 -частинок на тонких (товщина » 1 мкм) металічних плівках (фольгах) (рис.7.1).
-частинок на тонких (товщина » 1 мкм) металічних плівках (фольгах) (рис.7.1).
Центрований діафрагмою 2 пучок a-частинок від джерела 1 розсіювався фольгою 3 під різними кутами J від -p до p. Кількість a-частинок (Dn), розсіяних під фіксованими кутами, реєструвалась приймачем 4, який міг переміщуватись по колу навколо центру фольги. Було встановлено (рис.7.2):
а) більшість a-частинок, проходячи через фольгу, практично не розсіюється;
б) дуже добре виконується теоретично передбачуване співвідношення 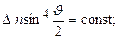
в) певна, хоч і незначна, кількість a-частинок розсіюється під кутами, близькими до ±p.
 Аналіз результатів експерименту дозволив Резерфорду запропонувати ядерну модель атома, згідно з якою в центрі атома
Аналіз результатів експерименту дозволив Резерфорду запропонувати ядерну модель атома, згідно з якою в центрі атома  розміщене позитивно заряджене ядро
розміщене позитивно заряджене ядро  , що володіє масою, приблизно рівною масі атома. Навколо ядра рухаються електрони. Якщо в нейтральному атомі Z електронів, де Z – порядковий номер елементу в періодичній таблиці елементів Д.І. Менделєєва, то заряд ядра
, що володіє масою, приблизно рівною масі атома. Навколо ядра рухаються електрони. Якщо в нейтральному атомі Z електронів, де Z – порядковий номер елементу в періодичній таблиці елементів Д.І. Менделєєва, то заряд ядра 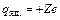 , де
, де 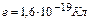 – елементарний заряд. В рамках цієї моделі зрозуміло, що ймовірність лобового зіткнення a-частинки з ядром, яке забезпечує розсіяння на кути ±p, дуже мала. Електрони ж в силу незначної маси розсіювати a-частинки не можуть.
– елементарний заряд. В рамках цієї моделі зрозуміло, що ймовірність лобового зіткнення a-частинки з ядром, яке забезпечує розсіяння на кути ±p, дуже мала. Електрони ж в силу незначної маси розсіювати a-частинки не можуть.
Оскільки, у відповідності з теоремою Ірншоу, неможлива стійка статична конфігурація електричних зарядів, то атом мусить бути динамічною системою, тобто електрони повинні рухатись навколо ядра по замкнених (колових чи еліптичних) орбітах. Такий рух є прискореним, і електрон з точки зору класичної фізики повинен втрачати енергію, випромінюючи електромагнітні хвилі, і тому впасти на ядро. Але, як відомо, атом – стійка конфігурація електричних зарядів. І тому, приймаючи ядерну модель атома, потрібно відмовитись від класичного опису орбітального руху електронів.
7.1.2. Розвиваючи запропоновану модель, у 1913 р. Н. Бор висунув гіпотезу у вигляді наступних постулатів: а) із усіх можливих механічних станів (орбіт) електрона в атомі здійснюються лише такі, для яких момент імпульсу орбітального руху електрона кратний до постійної Планка h, тобто
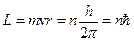 , (7.1)
, (7.1)
 де
де 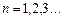 – квантове число стану (номер орбіти), а
– квантове число стану (номер орбіти), а 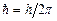 – постійна Дірака; такі стани називаються стаціонарними;
– постійна Дірака; такі стани називаються стаціонарними;
б) перебуваючи в стаціонарному стані, електрон атома не випромінює і не поглинає енергії;
в) при переході з одного стаціонарного стану на інший електрон випромінює чи поглинає квант світла з енергією, рівною різниці енергій цих станів, тобто
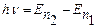 . (7.2)
. (7.2)
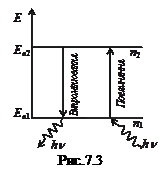
Отже, основна ідея постулатів Бора полягає в квантуванні (дискретності) механічних характеристик руху електронів: моменту імпульсу, енергії тощо. Рис.7.3 ілюструє наявність стаціонарних квантових станів (енергетичних рівнів) з енергіями 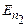 та
та 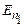 і випромінювальні та поглинальні переходи між ними: зменшення енергії електрона супроводжується випромінюванням кванту світла (фотона) з енергією
і випромінювальні та поглинальні переходи між ними: зменшення енергії електрона супроводжується випромінюванням кванту світла (фотона) з енергією 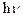 ; поглинання кванту світла з енергією
; поглинання кванту світла з енергією 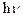 забезпечує збільшення енергії електрона від
забезпечує збільшення енергії електрона від 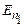 до
до 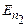 . В цій моделі випромінювання (поглинання) квантів світла з енергіями
. В цій моделі випромінювання (поглинання) квантів світла з енергіями 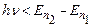 є неможливим.
є неможливим.
7.1.3. Запропонована теорія вперше була застосована до воднеподібних атомів ( 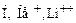 тощо), в яких навколо ядра, заряд якого
тощо), в яких навколо ядра, заряд якого 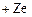 , рухається по коловій орбіті радіусом r лише один електрон. При цьому ядро вважається нерухомим. Розглядаючи електрон як класичну матеріальну точку, енергію атома запишемо як суму кінетичної і потенціальної енергій електрона в кулонівському полі ядра
, рухається по коловій орбіті радіусом r лише один електрон. При цьому ядро вважається нерухомим. Розглядаючи електрон як класичну матеріальну точку, енергію атома запишемо як суму кінетичної і потенціальної енергій електрона в кулонівському полі ядра
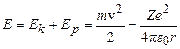 , (7.3)
, (7.3)
де m – маса електрона, 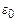 – електрична стала. Врахуємо, що в ролі доцентрової сили, яка забезпечує коловий рух електрона, виступає кулонівська сила, тобто
– електрична стала. Врахуємо, що в ролі доцентрової сили, яка забезпечує коловий рух електрона, виступає кулонівська сила, тобто
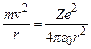 . (7.4)
. (7.4)
Звідси випливає, що 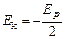 , і (7.3) запишеться у вигляді
, і (7.3) запишеться у вигляді
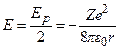 . (7.5)
. (7.5)
Оскільки орбітальний момент імпульсу електрона
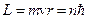 ,
,
то, врахувавши (7.4), отримаємо вираз для радіуса стаціонарної орбіти електрона
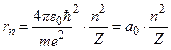 , (7.6)
, (7.6)
де  має зміст радіуса першої (n = 1) орбіти електрона в атомі водню (Z = 1); ця величина називається борівським радіусом. Отже, має місце квантування (n = 1, 2, 3, …) радіусів стаціонарних орбіт електрона.
має зміст радіуса першої (n = 1) орбіти електрона в атомі водню (Z = 1); ця величина називається борівським радіусом. Отже, має місце квантування (n = 1, 2, 3, …) радіусів стаціонарних орбіт електрона.
Підставляючи (7.6) у (7.5), отримаємо вираз для енергії атома
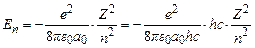 . (7.7)
. (7.7)
Введемо позначення:  – постійна Рідберга. Тоді (7.7) набуде остаточного вигляду
– постійна Рідберга. Тоді (7.7) набуде остаточного вигляду
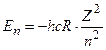 . (7.8)
. (7.8)
Отже, енергія атома приймає дискретні значення, тобто квантується. Стан з найнижчою енергією (n = 1) називається основним, усі інші стани – збудженими. Стан з найвищою енергією (n = ¥) відповідає іонізації атома. Отже, енергія іонізації воднеподібних атомів
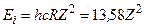 , (еВ).
, (еВ).
І тому зручно інколи (7.8) записувати у вигляді
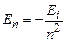 . (7.9)
. (7.9)
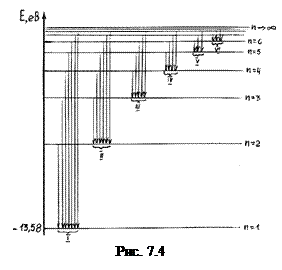
7.1.4.Зобразимо енергетичну діаграму атома водню (Z = 1) (рис.7.4). В основному стані атом може перебувати як завгодно довго. Якщо ж його перевести певним чином (теплом, світлом, бомбардуванням вільними електронами тощо) в довільний збуджений стан, то тривалість перебування в цьому стані складає 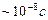 , і атом самовільно переходить в основний чи нижчі збуджені стани, як показано на рис. 7.4. При цьому, у відповідності з (7.2) та (7.8), випромінюється фотон з енергією
, і атом самовільно переходить в основний чи нижчі збуджені стани, як показано на рис. 7.4. При цьому, у відповідності з (7.2) та (7.8), випромінюється фотон з енергією
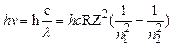 ,
,
а довжина випромінюваної світлової хвилі розраховується за серіальною формулою Бальмера
 , (7.10)
, (7.10)
де n2 – квантове число стану, з якого відбувається перехід, n1 – квантове число стану, в який переходить атом.
Якщо забезпечити умови “заселеності” усіх збуджених станів, то в спектрі випромінювання атомарного водню спостерігатиметься значна кількість спектральних ліній, які можна згрупувати в наступні серії:
І–серія Лаймана, для якої  а
а 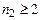 ;
;
ІІ–серія Бальмера, для якої 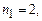 а
а 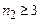 ;
;
ІІІ–серія Пашена, для якої  а
а 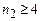 ;
;
ІV–серії Брекета, для якої  а
а 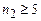 , тощо.
, тощо.
Лінії серії Лаймана лежать в ультрафіолетовій області, серії Бальмера – у видимій області, серії Пашена, Брекета – в інфрачервоній області. Відмітимо, що довжини хвиль, розраховані за формулою (7.10), дуже добре співпадають з експериментальними значеннями.
 На цьому тріумф теорії Бора закінчується, бо вона виявилась нездатною пояснити спектри випромінювання складних (неводнеподібних) атомів, а також інтенсивності спектральних ліній навіть атомарного водню. Слабкість цієї теорії полягає в тому, що, ввівши нехарактерні для класичної фізики поняття про квантування фізичних величин і про квантові переходи (”стрибки”), в усьому іншому вона залишилась класичною. І тому послідовна, квантовомеханічна теорія повинна ґрунтуватись на нових (некласичних) принципах опису стану і руху мікрочастинок.
На цьому тріумф теорії Бора закінчується, бо вона виявилась нездатною пояснити спектри випромінювання складних (неводнеподібних) атомів, а також інтенсивності спектральних ліній навіть атомарного водню. Слабкість цієї теорії полягає в тому, що, ввівши нехарактерні для класичної фізики поняття про квантування фізичних величин і про квантові переходи (”стрибки”), в усьому іншому вона залишилась класичною. І тому послідовна, квантовомеханічна теорія повинна ґрунтуватись на нових (некласичних) принципах опису стану і руху мікрочастинок.
Дата добавления: 2014-12-03; просмотров: 582; Мы поможем в написании вашей работы!; Нарушение авторских прав |