
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Дослід Резерфорда. Ядерна модель атома. Квантові постулати Бора
Відкриття складної будови атома - найважливіший етап становлення сучасної фізики, який позначився на ньому її наступному розвитку. У процесі створення теорії будови атома, яка пояснила атомні спектри, відкрито нові закони руху мікрочастинок - закони квантової механіки.
Не відразу вчені дійшли правильного розуміння будови атома. Після перших експериментів можна було робити висновки про складну будову атома і наявність в його структурі електричних зарядів. Ці результати отримано М. Фарадеєм 1833 року під час вивчення законів електролізу. 1897 року Дж. Томсон у результаті експериментів з вивчення електричного розряду в розріджених газах явища фотоефекту відкрив електрон. Він виміряв важливу характеристику цієї частинки - питомий заряд - e/m = 1,76·10-11 Кл/кг. Американський фізик Міллікен 1909 року дуже точно виміряв заряд електрона. Він виявився однаковим у всіх електронів і дорівнює:
e = – 1,6·10-19 Кл.
Маса електрона є приблизно в 2000 разів меншою за масу одного з найлегших атомів - атома водню - і дорівнює me = 9,1·10-31 кг. Виходячи з цих даних, Томсон запропонував модель атома, згідно якою атом є зарядженою кулею радіусом R 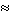 10-8 см, всередині якої знаходяться електрони. Більш складні атоми в додатно зарядженій кулі мають декілька електронів. Таким чином, атом подібний пиріжка, роль родзинок при цьому відіграють електрони.
10-8 см, всередині якої знаходяться електрони. Більш складні атоми в додатно зарядженій кулі мають декілька електронів. Таким чином, атом подібний пиріжка, роль родзинок при цьому відіграють електрони.
Однак модель атома Томсона виявилась повністю відмінною від моделі, яку запропонував Резерфорд у результаті своїх досліджень. Резерфорд 1906 року запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів, які називають дослідами Резерфорда (рис. 7.7). Він зондував атоми золота швидкорухомими ядрами гелію (a частинками).

Навпроти отвору в свинцевому контейнері на екрані, покритому ZnSO4, можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що лише незначна частина ядер відхиляється на значні кути і дуже мало ядер відбивались назад. Узагальнивши результати дослідів, Резерфорд зробив висновки:
- в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10-15 м.
- ядро несе в собі заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер цього елемента в таблиці Менделєєва.
- оскільки атом електрично нейтральний, то позитивний заряд ядра компенсує заряд електронів, які мають рухатись навколо ядра, подібно до планет навколо Сонця. Кількість електронів дорівнює порядковому номеру елемента в таблиці Менделєєва. Таку модель атома Резерфорд назвав планетарною моделлю атома.
Планетарна модель атома багато пояснила в будові атома, але одразу після її створення виникли труднощі: ядро заряджено позитивно, а електрони - негативно. Між ними існує кулонівська сила притягання. Для того, щоб електрони не впали на ядро, вони мусять рухатись навколо нього з доцентровим прискоренням. З теорії Максвелла випливає, що якщо заряд рухається з прискоренням, то при цьому має випромінюватись електромагнітна хвиля, а розрахунки показують, що за час Dt 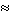 10-8 c електрон, рухаючись по спіралі мусить припинити свій рух.
10-8 c електрон, рухаючись по спіралі мусить припинити свій рух.
Дослідні ж дані показували, що за нормальних умов атом не випромінює енергію і існує як завгодно довго.
Вихід із ситуації 1913 року запропонував датський фізик Нільс Бор. Він створив теорію атома на основі таких постулатів:
1. Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія En. У стаціонарному стані атом енергію не  випромінює.
випромінює.
2. Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких hn визначають за формулою
hnkn = Ek – En, (1)
де k і n - цілі числа (номери стаціонарних станів), якщо Ek > En фотон з частотою nkn випромінюється, якщо Ek < En - поглинається.
3. Радіуси rn стаціонарних станів задовольняють умову:
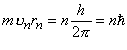 . (2)
. (2)
де n = 1, 2, 3, …, m - маса електрона, 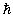 - зведена стала Планка.
- зведена стала Планка.
Інколи частоту випромінювання можна записати таким чином:
 . (3)
. (3)
Поглинаючи світло, атом переходить із стаціонарного стану з меншою енергією в стаціонарний стан з більшою енергією. Усі стаціонарні стани, крім одного, є умовно стаціонарними. Нескінченно довго кожен атом може знаходитись лише в стаціонарному стані з мінімальним запасом енергії. Цей стан атома називається основним, всі інші - збудженими.
Постулати Бора дозволяють визначити частоти випромінювання атомів водню під час переходу між різними станами. Усі частоти випромінювань атома водню складають низку серій, кожна з яких утворюється під час переходу атома з одного енергетичного стану в інший (рис. 7.8).
Існують такі серії:
1. серія Лаймана, що відповідає переходу електрона на першу орбіту з другої, третьої і т. д.
2. серія Бальмера, коли електрони переходять на другу орбіту з третьої, четвертої і т.д.
3. серія Пашена, коли переходять електрони на третю орбіту або на третій рівень з четвертої, п'ятої і т. д.
Поглинання світла - процес зворотний випромінюванню. Атом, поглинаючи світло переходить із нижчих енергетичних станів до вищих. При цьому він поглинає випромінювання з такою самою чистотою, що й випромінює.
На основі постулатів Бора можна визначити частоти nkn і nnk атомів електромагнітних хвиль, що випромінюють:
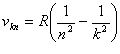

де R = 3,27·1015 c-1 - стала Ридберга.
Найбільший успіх теорія Бора мала в застосуванні до атома водню, для якого вдалося побудувати кількісну теорію спектра. Проте побудувати кількісну теорію вже для наступного за воднем атома гелію за допомогою постулатів Бора не вдалося. Ця теорія була штучним поєднанням класичних законів фізики і квантових уявлень.
Дата добавления: 2014-12-03; просмотров: 621; Мы поможем в написании вашей работы!; Нарушение авторских прав |