
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
| ВСТУП……………………………………………………………………… | |
| ЧАСТИНА 1. АНАЛІЗ НЕПЕРЕРВНОІ ЛІНІЙНОІ САК…………………………………………………………………………. | |
| ЧАСТИНА 2. АНАЛІЗ ДИСКРЕТНОІ САК………………………. | |
| ЧАСТИНА 3. АНАЛІЗ НЕЛІНІЙНОІ САК……………………….. | |
| Додатки | |
| Додаток 1. Завдання на курсову роботу…………………………… | |
| АНАЛІЗ НЕПЕРЕРВНОІ ЛІНІЙНОІ САК….……… | |
| Додаток 2. АНАЛІЗ ДИСКРЕТНОI САК………………………….. | |
| Додаток 3. АНАЛІЗ НЕЛІНІЙНОІ САК…………………………… | |
| ЛІТЕРАТУРА……………………………………………………………… |
КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 1.1).
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узламирешетки. Расстояния a, b и c между центрами атомов, находящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм.
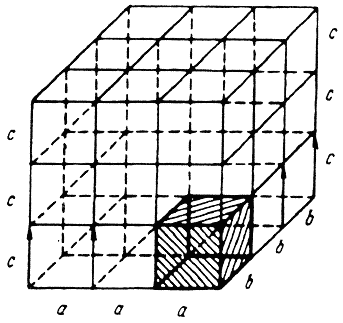
Рис. 1.1. Кристаллическая решетка
Для однозначного описания элементарной ячейки кристаллической решетки необходимо знание величин параметров a,b, c и углов между ними.
В 1848 г. французский ученый Бравэ показал, что изученные трансляционные структуры и элементы симметрии позволяют выделить 14 типов кристаллических решеток.
На рис. 1.2 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерные для металлов: объемноцентрированная кубическая (ОЦК); гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП), а также схемы упаковки в них атомов.
В кубической гранецентрированной решетке (ГЦК; А1) атомы расположены в вершинах куба и в центре каждой грани (рис. 1.2, б).
В кубической объемноцентрированной решетке (ОЦК; А2) атомы расположены в вершинах куба, а один атом — в центре его объема (рис. 1.2, а).
В гексагональной плотноупакованной решетке (ГП; А3) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы (рис. 1.2, в).
Для характеристики кристаллических решеток вводят понятия координационного числа и коэффициента компактности. Координационным числом Iкназывается число атомов, находящихся на наиболее близком и равном расстоянии от данного атома. Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12.

Рис. 1.2. Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов:
а) гранецентрированная кубическая (ГЦК);
б) объемноцентрированная кубическая (ОЦК);
в) гексагональная плотноупакованная (ГП) решетка
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке, помимо атомов, имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки:

где R — радиус атома (иона); n — базис, или число атомов, приходящихся на одну элементарную ячейку; V — объем элементарной ячейки.
Для простой кубической решетки n = (1/8) · 8 = 1; V = a3 = (2R)3, коэффициент компактности Q = 52 %.
Схема определения базиса ОЦК решетки приведена на рис. 1.3. На решетку ОЦК приходится два атома: один центральный и один как сумма от вершин куба, так как ячейке принадлежит 1/8 атома от каждого угла.
Для ОЦК решетки n = (1/8) · 8 + 1 = 2. Учитывая, что атомы соприкасаются по диагонали куба, длина которой равна 4 атомным радиусам, параметр решетки а коэффициент компактности QОЦК = 68 %.
Проведя аналогичные вычисления, найдем QГЦК = 74 %, QГП = 74 %.
Таким образом, решетки ГЦК и ГП более компактны, чем ОЦК.
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом α (α-Fe), при более высокой индексом β, затем γ и т.д.
Известны полиморфные превращения железа:
Fea « Feg (a-Fe « g-Fe), титана Tia « Tig
(a-Ti « g- Ti) и других элементов.
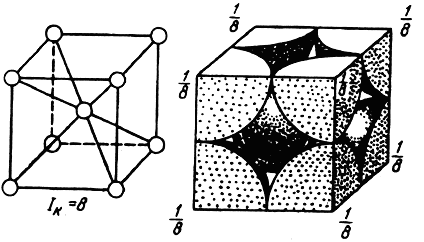
Рис. 1.3. Схема определения базиса ОЦК решетки
Температура превращения одной кристаллической модификации в другую называется температурой полиморфного превращения.
При полиморфном превращении меняются форма и тип кристаллической решетки. Это явление называется перекристаллизацией. Так, при температуре ниже 911 °С устойчиво Fea, в интервале 911–1392 °С устойчиво Feg. При нагреве выше 911 °С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка.
При переходе из одной полиморфной формы в другую меняются свойства, в частности плотность и соответственно объем вещества. Например, плотность Feg на 3 % больше плотности Fea, а удельный объем соответственно меньше. Эти изменения объема необходимо учитывать при термообработке.
Полиморфизм олова явился одной из причин гибели полярной экспедиции английского исследователя Р. Скотта. Оловом были запаяны канистры с керосином. При низкой температуре произошло полиморфное превращение пластичного белого олова с образованием хрупкого порошка серого олова. Горючее вылилось и испарилось, и на обратном пути экспедиция осталась без топлива. Превращение белого олова в серое называют «оловянной чумой».
Типы кристаллических решеток важнейших металлических элементов приведены в табл. 1.1.
Таблица 1.1.
Дата добавления: 2014-12-23; просмотров: 381; Мы поможем в написании вашей работы!; Нарушение авторских прав |