
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия ионизации
Важной характеристикой атома, элементы определяющей его способность отдавать электрон, является энергия ионизации (Еи).
Энергия ионизации – это энергия, необходимая для удаления одного моля электронов от одного моля нейтральных атомов данного элемента и образованием при этом положительно заряженных атомов (ионов).
Различают первую Еи,1, вторую Еи,2 и последующие энергии ионизации, то есть энергии, отвечающие удалению первого, второго и каждого последующего электрона из многоэлектронного атома.
Удаление первого электрона описывается уравнением:
Э + Еи,1 → Э+ + ē,
где Э –нейтральный атом элемента;
Э+ – положительно заряженный атом (ион);
Еи,1 – первая энергия ионизации, кДж/моль или эВ*.
По мере последовательного удаления электронов положительный заряд образующихся ионов растёт, и увеличивается взаимодействие электронов с атомным ядром. Поэтому для удаления каждого последующего электрона требуется значительно бόльшая энергия (табл. 6):
Э  Э+
Э+  Э2+
Э2+  …
…  Эn+;
Эn+;
Еи,1 < Еи,2 < Еи,3 … < Еи,n.
Энергия ионизации является функцией заряда ядра и радиуса атомов элементов, а также характера межэлектронного взаимодействия.
Еи = f (Z, rат, межэлектронное взаимодействие).
При прочих равных условиях энергия ионизации обратно пропорциональна величине радиуса атома элемента, то есть чем дальше электроны находятся от атомного ядра, тем слабее их взаимодействие с этим ядром.
В многоэлектронном атоме на энергию взаимодействия внешних электронов с атомным ядром оказывает эффект экранирования, заключающийся в уменьшении воздействия на эти электроны заряда атомного ядра из-за наличия внутренних электронных слоёв. Экранирование, возрастая с увеличением числа внутренних электронных слоёв, ослабляет взаимодействие внешних электронов с атомным ядром. В результате на наиболее удалённые от атомного ядра внешние электроны действует не полный его заряд Z, а значительно меньший эффективный заряд Zэф..
Таблица 6
Энергии ионизации атомов s- и p-элементов, эВ
| Атом | Еи,1 | Еи,2 | Еи,3 | Еи,4 | Еи,5 |
| H | 13,6 | ||||
| He | 24,6 | 54,4 | |||
| Li | 5,4 | 75,6 | 122,4 | ||
| Be | 9,3 | 18,2 | 153,8 | 217,7 | |
| B | 8,3 | 25,1 | 37,9 | 259,3 | 340,1 |
| C | 11,2 | 24,4 | 47,9 | 64,5 | 392,0 |
В периоде наименьшую энергию ионизации (способность отдавать наиболее слабосвязанный с атомным ядром электрон) имеют атомы группы IA – атомы щелочных металлов (рис. 10), так как у них во внешнем электронном слое находится один электрон, который значительно удалён от ядра. Поэтому характерной особенностью атомов щелочных металлов является их склонность к отдаче электронов с образованием однозарядных положительных ионов.
При переходе слева направо по периоду, вследствие увеличения заряда атомных ядер и уменьшения радиуса атомов элементов, энергия ионизации в основном растёт и достигает максимумов у атомов благородных газов, обладающих энергетически устойчивой электронной конфигурацией ns2np6 (рис. 10). После завершения периода величина энергии ионизации резко снижается при переходе к атомам щелочных металлов, начинающих новый период.
В пределах групп А (s- и р-элементы) энергия ионизации атомов уменьшается сверху вниз (рис. 11). Это означает, что на взаимодействие внешнего электрона с атомным ядром больше влияет увеличение радиуса атомов, чем заряда их ядер, эффективная величина которых понижается за счёт экранирования электронами внутренних слоёв.

Рис. 10. Периодическая зависимость первой энергии ионизации
атомов элементов (эВ) от порядкового номера Z
В группах Б (за исключением III группы), изменение энергии ионизации носит обратный характер, увеличиваясь сверху вниз (рис. 11). Это связано с тем, что увеличение радиуса атомов элементов в группах Б относительно невелико, и поэтому увеличение заряда атомных ядер оказывает на энергию ионизации определяющее (более сильное) влияние, и внешний электрон притягивается атомным ядром сильнее.
Энергия ионизации является мерой восстановительной способности атомов элементов. Чем она меньше, тем легче атомы отдают электроны, и тем сильнее они проявляют восстановительные свойства.
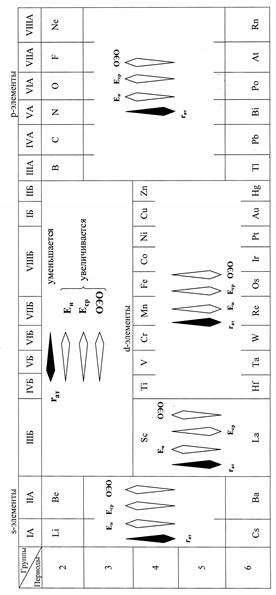
| Рис. 11. Изменение основных характеристик атомов элементов в периодах и группах периодической системы Д.И. Менделеева |
Дата добавления: 2014-12-30; просмотров: 522; Мы поможем в написании вашей работы!; Нарушение авторских прав |