
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Площадь поверхности соприкосновения реагирующих веществ
Чем больше площадь поверхности соприкосновения исходных веществ , тем больше реагирующих частиц сталкиваются друг с другом и тем выше скорость их взаимодействия
28Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производстве серной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — каталитические.
Случай, когда катализатором является один из продуктов реакции или ее исходных веществ, называютавтокатализом.
Содержание
[убрать]
· 1 Основные принципы катализа
· 2 Типы катализа
o 2.1 Гомогенный катализ
o 2.2 Гетерогенный катализ
· 3 Носитель катализатора
· 4 Химия катализа
· 5 Применение катализа в промышленности
o 5.1 Гидрирование
o 5.2 Кислотный катализ
§ 5.2.1 Гидрирование растительного масла
§ 5.2.2 Дегидрирование
§ 5.2.3 Аммиак
o 5.3 Основной катализ
o 5.4 Катализаторы двойного действия
o 5.5 Стереоспецифическая полимеризация
o 5.6 Каталитическое окисление
§ 5.6.1 Получение этилена путем дегидродимеризации метана
§ 5.6.2 Катализаторы гетерогенного окисления
· 6 См. также
· 7 Примечания
· 8 Литература
Основные принципы катализа[править | править вики-текст]
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции как в прямом, так и в обратном направлениях. Поэтому они не смещают химическое равновесие[2].
Типы катализа[править | править вики-текст]
По влиянию на скорость реакции катализ многие источники делят на положительный (скорость реакции растет) и отрицательный (скорость реакции падает). В последнем случае происходит процесс ингибирования, который нельзя считать 'отрицательным катализом', поскольку ингибитор в ходе реакции расходуется.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
Гомогенный катализ[править | править вики-текст]
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ[править | править вики-текст]
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
Течение реакции именно на поверхности катализатора можно продемонстрировать на опыте, в котором пластинку изплатины нагревают в пламени газовой горелки, затем пламя тушат и пускают на пластинку струю газа из горелки, при этом пластинка снова раскаляется докрасна — окисление метана происходит на поверхности металла[3].
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции.
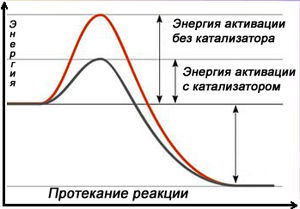
Схема протекания реакции с катализатором
Содержание
[убрать]
· 1 Типы катализаторов
· 2 Катализаторы в химии
· 3 Катализаторы в автомобилях
· 4 Интересные факты
· 5 См. также
· 6 Примечания
· 7 Ссылки
Типы катализаторов[править | править вики-текст]
Катализаторы классифицируют исходя из природы реакции, которую они ускоряют, их химического состава или физических свойств. Каталитическими свойствами обладают в той или иной степени практически все химические элементы и вещества — сами по себе или, чаще, в различных сочетаниях. По своим физическим свойствам катализаторы делятся на гомогенные и гетерогенные. Гетерогенные катализаторы — это твердые вещества, гомогенные диспергированы в той же газовой или жидкой среде, что и реагирующие вещества.
Многие гетерогенные катализаторы содержат металлы. Некоторые металлы, особенно относящиеся к VIII группе периодической системы элементов, обладают каталитической активностью сами по себе; типичный пример — платина. Но большинство металлов проявляют каталитические свойства, находясь в составе соединений; пример — глинозем (оксид алюминия Al2O3).
Необычным свойством многих гетерогенных катализаторов является большая площадь их поверхности. Они пронизаны многочисленными порами, суммарная площадь которых иногда достигает 500 квадратных метров на 1 г катализатора. Во многих случаях оксиды с большой площадью поверхности служат подложкой, на которой в виде небольших кластеров осаждаются частички металлического катализатора. Это обеспечивает эффективное взаимодействие реагентов в газовой или жидкой фазе с каталитически активным металлом. Особый класс гетерогенных катализаторов составляют цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия). Хотя многие гетерогенные катализаторы обладают большой площадью поверхности, обычно они имеют лишь небольшое число активных центров, на долю которых приходится малая часть суммарной поверхности. Катализаторы могут утрачивать свою активность в присутствии небольших количеств химических соединений, называемых каталитическими ядами. Эти вещества связываются с активными центрами, блокируя их. Определение структуры активных центров является предметом интенсивных исследований.
Гомогенные катализаторы имеют различную химическую природу — кислоты (Н2SO4 или Н3РО4), основания (NaOH), органические амины, металлы, чаще всего переходные (Fe или Rh), в форме солей, металлоорганических соединений или карбонилов. К катализаторам относятся также ферменты — белковые молекулы, регулирующие биохимические реакции. Активный центр некоторых ферментов содержит атом металла (Zn, Cu, Fe или Mo). Металлсодержащие ферменты катализируют реакции с участием малых молекул (О2, CO2 или N2). Ферменты обладают очень высокой активностью и селективностью, но работают только при определенных условиях, таких, в которых протекают реакции в живых организмах. В промышленности часто используют т.н. иммобилизованные ферменты.
29ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты Продукты Продукты
|
Все химические реакции, в принципе, обратимы.
Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ).
Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты.
Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S FeS FeS
|
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2  2NH3 2NH3
|
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается.
Прямая и обратная реакции протекают одновременно в противоположных направлениях.
| Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
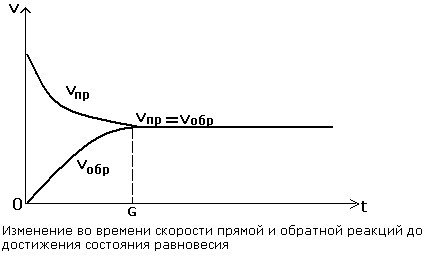
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Дата добавления: 2014-12-30; просмотров: 590; Мы поможем в написании вашей работы!; Нарушение авторских прав |