
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Замерзание и кипение растворов.
Индивидуальные вещества характеризуются строго определенными температурами переходов из одного агрегатного состояния в другое (температура кипения, температура плавления или кристаллизации). Так, вода при нормальном атмосферном давлении  ) кристаллизуется при температуре
) кристаллизуется при температуре  и кипит при
и кипит при 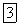 .
.
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется (при замерзании) или выкипает (при кипении) только растворитель вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения.
Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора  . Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора
. Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора  .
.
Обозначая температуры кипения и замерзания раствора  и
и  , а те же величины для чистого растворителя
, а те же величины для чистого растворителя  и
и  , имеем:
, имеем:

Всякая жидкость начинает кипеть при той температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Например, вода под давлением  кипит при
кипит при  потому, что при этой температуре давление водяного пара как раз равно
потому, что при этой температуре давление водяного пара как раз равно  . Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до
. Если же растворить в воде какое-нибудь нелетучее вещество, то давление ее пара понизится. Чтобы довести давление пара полученного раствора до  , нужно нагреть раствор выше
, нужно нагреть раствор выше  . Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
. Отсюда следует, что температура кипения раствора всегда выше температуры кипения чистого растворителя. Аналогично объясняется и понижение температуры замерзания растворов.
Повышение температуры кипения и понижение температуры замерзания растворов соответствуют принципу Ле Шателье. Рассмотрим в этом плане замерзание раствора. Пусть имеется равновесие между жидкостью и твердой фазой, например, равновесие вода—лед при  . Его можно выразить уравнением:
. Его можно выразить уравнением:
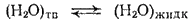
Если растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий ее, — плавление льда. Для установления нового равновесия необходимо понизить температуру.
Повышение температуры кипения и понижение температуры замерзания находят отражение на диаграмме состояния. На рис. 79 приведена часть диаграммы состояния воды и раствора — отрезки кривых плавления и кипения в области давлений, близких к нормальному атмосферному давлению  .
.
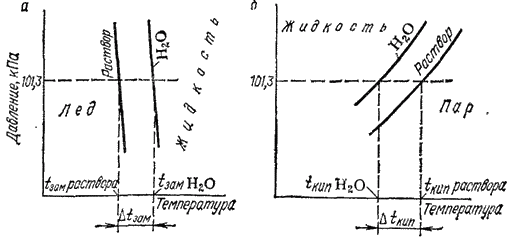
Рис. 79. Часть диаграммы состояния воды и раствора в области давлений близких к  (схема): а — кривые плавления; б — кривые киления.
(схема): а — кривые плавления; б — кривые киления.
Отрезки пересечены горизонталью, отвечающей давлению 101,3  (масштаб чертежа увеличен по сравнению с рис. 73 и 78). Видно, что точки пересечения этой горизонтали с .кривыми плавления и кипения для воды и для раствора различны. Абсциссы этих точек — температура замерзания и температура кипения — для воды равны 0 и
(масштаб чертежа увеличен по сравнению с рис. 73 и 78). Видно, что точки пересечения этой горизонтали с .кривыми плавления и кипения для воды и для раствора различны. Абсциссы этих точек — температура замерзания и температура кипения — для воды равны 0 и  , а для раствора они соответственно ниже
, а для раствора они соответственно ниже  и выше
и выше  . Кривые, отвечающие раствору, тем больше удалены от соответствующих кривых воды, чем концентрированнее раствор. Поэтому и разность между температурами кипения или замерзания воды и раствора тем больше, чем выше концентрация раствора.
. Кривые, отвечающие раствору, тем больше удалены от соответствующих кривых воды, чем концентрированнее раствор. Поэтому и разность между температурами кипения или замерзания воды и раствора тем больше, чем выше концентрация раствора.
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:

Здесь m — молярная концентрация (моляльность); Е и К —  и
и  постоянные, зависящие только от природы растворителя, но не зависящие от природы растворенного вещества. Для воды криоскопическая постоянная К равна 1,86, эбуллиоскопическая постоянная Е равна 0,52. Для бензола К=5,07, Е=2,6.
постоянные, зависящие только от природы растворителя, но не зависящие от природы растворенного вещества. Для воды криоскопическая постоянная К равна 1,86, эбуллиоскопическая постоянная Е равна 0,52. Для бензола К=5,07, Е=2,6.
На измерениях температур кипения и замерзания растворов основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ. Оба метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Пример. При растворении 2,76 г. глицерина в 200 г. воды температура замерзания понизилась на 0,279 градусов. Определить молекулярную массу глицерина.
Находим, сколько граммов глицерина приходится в растворе на 1000 г. воды:
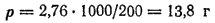
Выражаем моляльность раствора  через массу глицерина
через массу глицерина  , приходящуюся на 1000 г. воды, и его молярную массу
, приходящуюся на 1000 г. воды, и его молярную массу 
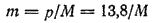
Подставляем данные в уравнение:
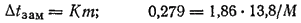
Отсюда молярная масса глицерина М — 92 г/моль, а молекулярная масса равна 92.
Дата добавления: 2014-12-30; просмотров: 419; Мы поможем в написании вашей работы!; Нарушение авторских прав |