
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методы диспергирования
– механическое диспергирование – осуществляется под действием внешней механической работы. Способы: истирание, раздавливание, раскалывание, распыление, барботаж (пропускание струи воздуха через жидкость), встряхивание, взрыв, действие звуковых и ультразвуковых волн. Таким методом получают муку, сахарную пудру, какао порошок, пряности, молотый кофе и другие. Размер частиц, получаемых этим методом, к.п. довольно большой, не менее 100 нм. Оборудование: ступки, мельницы, дробилки различных типов, жернова.
Для повышения эффективности механическое диспергирование проводят в жидкой среде. Жидкости (растворы ПАВ, электролитов), смачивающие твердое тело, адсорбируются на нем и снижают прочность при механической обработке. Это называется адсорбционное понижение прочности твердых тел или эффект Ребиндера (обосновано в 1982 г. П.А. Ребиндером).
– электрическое диспергирование – основан на образовании вольтовой дуги между электродами из распыляемого металла, помещенными в охлаждаемую ДС. Металлы при температуре вольтовой дуги испаряются, а затем в холодной ДС конденсируются. Таким методом получают в основном гидрозоли металлов (дисперсионной средой является вода), например серебра, золота и платины.
– диспергирование ультразвуком – основано на воздействии при помощи ультразвуковых колебаний с частотой выше 20 тыс. в 1 с., не улавливаемых человеческим ухом, эффективно лишь для веществ с небольшой прочностью. К ним относят серу, графит, крахмал, каучук, желатин и др.
К физико-химическому диспергированию относится метод пептизации. Он заключается в переводе свежеприготовленных рыхлых осадков в коллоидный раствор под действием специальных стабилизирующих добавок (пептизаторов – электролиты, растворы ПАВ). Действие пептизатора заключается в том, что частицы осадка отделяются друг от друга и переходят во взвешенное состояние, образуя золь. Таким методом можно получить, например, гидрозоль гидроксида железа (III). Метод пептизации можно применять только для свежеприготовленных осадков, так как в процессе хранения происходят процессы рекристаллизации и старения, приводящие к сращиванию частиц друг с другом. Размеры частиц получаемых данным методом около 1 нм.
41Коллоидные частицы имеют сложное строение. Они состоят из ядер и адсорбированных и притянутых ионов. Рассмотрим строение коллоидной частицы кремниевой кислоты, которая образовалась в результате взаимодействия очень разбавленных растворов силиката натрия и соляной кислоты (Na2Si03 + 2HCl = H2Si03+ 2NaCl). Если Na2Si03 находится в избытке, то кремниевая кислота не выпадает в осадок, а образуется прозрачный коллоидный раствор H2Si03. Ядро коллоидной частицы нейтрально, оно состоит из m молекул H2Si03. На поверхности ядра адсорбируются n ионов Si032- , это потенциалопределяющие ионы, так как они обуславливают заряд частицы коллоидного раствора.
Адсорбированные потенциалопределяющие ионы притягивают из раствора ионы противоположного знака — противоионы. В данном случае это ионы Na+, причем часть их 2(n - х) адсорбируется на частице. Адсорбированные ионы Si032- вместе с противоионами Na+ образуют адсорбционный слой. Другая часть противоионов 2xNa+ находится в жидкой фазе и образует подвижный диффузный слой.
Ядро вместе с адсорбционным слоем называется гранулой.
В нашем примере гранула заряжена отрицательно, так как адсорбция ионов Si032-происходит сильнее, чем ионов Na-.
Коллоидная частица вместе с противоионами диффузионного слоя называется мицеллой. Это отдельная частица коллоидного раствора.
Мицелла (коллоидная частица)
42Коллоидные растворы (гидрозоли) по внешнему виду чаще всего мало отличаются от истинных растворов. При малых размерах частиц дисперсной фазы они прозрачны и не разделяются на фазы при использовании обычных фильтров. Примером гидрозоля является природная вода, взятая из любого пруда, реки или озера. В ней содержится огромное количество взвешенных частиц очень маленьких размеров, невидимых глазу, которые часто не видны даже при использовании микроскопа. Эти частицы нельзя отделить от воды отстаиванием или фильрованием через бумажный или матерчатый фильтр.
Примером аэрозоля является природный воздух, содержащий большое количество мельчайших частиц в твердом или жидком состоянии.
Драгоценнные и полудрагоценные камни (рубин, опал и др.) являются примером дисперсных систем типа "твердое вещество-твердое вещество".
Однако, немотря на внешнее сходство, коллоидные растворы обладают особыми свойствами, отличающими их от истинных растворов.
Часть этих отличий связана с разным размером частиц дисперсной фазы: в истинных растворах дисперсная фаза измельчена до размера молекул (менее 10-9 м), в золях - размер частиц - 10-5 - 10-7 м. Сравнительно большим размером частиц обусловлены многие молекулярно-кинетические и оптические свойства коллоидных растворов, отличающиеся от свойств истинных растворов.
Но главной особенностью коллоидных растворов является наличие у них электрических свойств. При наложении разности потенциала коллоидные частицы начинаются двигаться и, наоборот, при их движении в системе возникает разность потенциалов. Таким образом, коллоидные растворы напоминают собой растворы электролитов. Эти явления получили название электрокинетических явлений. Электрические свойства золей объясняют наличием заряда на поверхности коллоидных частиц, а открытие электрокинетических явлений послужило основой для создания теории строения коллоидных частиц..
43Устойчивость дисперсных систем – это возможность их нахождения в исходном состоянии неопределенно долгое время.
Устойчивость дисперсных систем может быть:
1. К осаждению дисперсной фазы - характеризует способность дисперсной системы сохранять равновесное распределение фазы по объему дисперсионной среды или ее устойчивость к разделению фаз. Это свойство называетсяседиментационная (кинетическая)устойчивость.
2. К агрегации ее частиц.
Агрегативная устойчивость – это способность дисперсной системы сохранять неизменной во времени степень дисперсности, т.е. размеры частиц и их индивидуальность.
Она обусловлена способностью дисперсных систем образовывать агрегаты (т.е. укрупняться). По отношению к агрегации дисперсные системы могут быть устойчивыми кинетически и термодинамически. Термодинамически устойчивые системы образуются в результате самопроизвольного диспергирования одной из фаз, т.е. самопроизвольного образования гетерогенной свободнодисперсной системы. Дисперсные системы также делят на:
· лиофильные, обладающие термодинамической устойчивостью;
· лиофобные, которые термодинамически неустойчивы к агрегации, но могут быть устойчивы кинетически, т.е. обладать значительным временем жизни.
Особенности этих двух видов устойчивости показаны на схеме:
SHAPE \* MERGEFORMAT
| Седиментационная |
| Агрегативная |
| Системы, устойчивые в условиях невесомости |
| Устойчивые высокодисперсные системы |
| Неустойчивые средне- и грубодисперсные системы |
| Устойчивые лиофильные системы |
| Неустойчивые лиофобные системы, |
| Механические, гидродинамические и другие внешние |
| Коагу-ляция |
| Коалес- ценция |
| Термодинамический фактор устойчивости |
| Кинетичес- кий фактор устойчивости (коллоидная защита) |
| Устойчивость дисперсных систем |


Термодинамическая устойчивость лиофильных систем означает, что они равновесны (энергия Гиббса DG ® min), обратимы и образуются самопроизвольно, как из макрофаз, так и из истинных растворов. Поскольку образуются гетерогенные системы, то поверхностная энергия должна быть скомпенсирована энтропийной составляющей, т.е. частицы дисперсной системы должны участвовать в молекулярно кинетическом (тепловом) движении. Отсюда следует, что лиофильные системы могут быть только ультромикрогетерогенными, а поверхностное натяжение на границе «частица – среда» должно быть очень малым. Значение поверхностного натяжения, при котором обеспечивается термодинамическая устойчивость дисперсных систем, определяется соотношением Ребиндера – Щукина:
 ,
,
безразмерный коэффициент; - gгде
K – постоянная Больцмана;
а – средний размер частицы.
Расчеты показывают, что межфазное поверхностное натяжение в лиофильных дисперсных системах в зависимости от размеров частиц может иметь значение от 1,4×10-7 до 1,4×10-3 Дж/м2. Типичными представителями лиофильных дисперсных систем являются растворы коллоидных поверхностно активных веществ (ПАВ) (ассоциативные коллоиды) и растворы полимеров (молекулярные коллоиды).
Лиофобные системы термодинамически неустойчивы, т.к. частицы дисперсной фазы склонны к агрегации. Их агрегативная термодинамическая неустойчивость обусловлена избытком поверхностной энергии. Межфазное натяжение в них больше рассчитанного по соотношению Ребиндера – Щукина, поэтому они не могут быть получены самопроизвольным диспергированием. Для их образования должна быть затрачена внешняя энергия. Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается двумя путями:
1. Изотермическая перегонка, т.е. растворение мелких и рост крупных частиц в соответствии с уравнением Кельвина;
2. За счет слипания частиц, т.е. коагуляцией.
В зависимости от природы среды и концентрации дисперсной фазы эти процессы могут заканчиваться или осаждением, или структурообразованием.
При нарушении агрегативной устойчивости происходит коагуляция.
Седиментация и диффузия. Гипсометрический закон. Седиментационно-диффузионное равновесие. Скорость седиментации
Грубодисперсные системы под действием гравитационных сил будут оседать (седиментировать). В результате в системе устанавливается определенное равновесие распределения частиц по высоте. Коллоидные системы по устойчивости занимают промежуточное положение между истинными растворами (max) и грубодисперсными растворами (min). На каждую частицу дисперсной фазы действует 3 силы:
1. Сила тяжести Fт.
2. Архимедова сила FA.
3. Сила трения Fтр.
Сила седиментации будет результирующей между первой и второй силой

Если  , Fсед > 0 – происходит оседание частиц. Если Fсед < 0 – то частицы всплывают. Результирующая сила, действующая на частицу:
, Fсед > 0 – происходит оседание частиц. Если Fсед < 0 – то частицы всплывают. Результирующая сила, действующая на частицу:
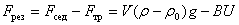 ,
,
где B – коэффициент трения; U – скорость седиментации.
|
44Конденсационные методы основаны на образовании новой фазы в условиях пересыщенного состояния веществ; при этом система из гомогенной превращается в гетерогенную.
Конденсационный процесс включает в себя две стадии:
1) образование центров конденсации (зародышей);
2) рост зародышей.
Доказано, что самопроизвольное образование зародышей за счет удачного столкновения молекул маловероятно. Зародыши образуются на уже имеющихся поверхностях раздела (пылинки или другие чужеродные частицы). В тщательно очищенных системах образование новой фазы не происходит даже при очень высоких степенях пересыщения. Рост зародышей происходит в результате отложения их на поверхности вещества из пересыщенной системы.
Размер образующихся частиц коллоидной системы и полидисперсность этой системы зависит от соотношения скоростей образования зародышей и их роста. Для образования монодисперсной коллоидной системы скорость образования зародышей (v1) должна быть велика, а скорость их роста (v2) мала.
Факторы, влияющие на скорость отдельных стадий процесса:
- растворимость дисперсной фазы в дисперсионной среде – чем она меньше, тем больше v1 и меньше v2 , то есть образуется мелкодисперсная система;
- концентрация дисперсной фазы в системе:
а) при малых концентрациях образуется мелкодисперсная система (коллоидный раствор), v1 > v2, т.к. v2 мала;
б) при больших концентрациях тоже образуется мелкодисперсная система (гель), v1 > v2 , т.к. v1 велика;
в) при средних концентрациях образуется крупнодисперсная система, v1 ≈ v2 ;
- температура: при повышенных температурах образуются мелкие кристаллы, при низких – более крупные аморфные образования;
- присутствие веществ, препятствующих образованию зародышей, или тормозящих их рост (механизм действия – адсорбционный);
- необходимым условием получения коллоидных систем является наличие стабилизатора.
Виды конденсационных методов:
1) физические процессы, протекающие при охлаждении системы: кристаллизация (образование твердой фазы в жидком растворе); конденсация (превращение паров в жидкость); десублимация (переход из газовой фазы в твердую).
2) химические процессы (реакции обмена, окисления, гидролиза и др.)
AgNO3(p) + KI(p) = Ag I(т) + KNO3 образуется гидрозоль
NH3(г) + HCl(г) = NH4Cl(т) образуется дым
SO3(г) + H2O(г) = H2SO4(ж) образуется туман
Диспергационные методы основаны на измельчении (диспергировании) грубых частиц и распределении их в объеме дисперсионной среды.
В зависимости от агрегатного состояния дисперсной фазы диспергирование достигается:
1) в случае твердой фазы – механическим измельчением с последующим перемешиванием в жидкой среде или распылением в газовой;
2) в случае жидкой фазы – интенсивным перемешиванием или разбрызгиванием с помощью специальных устройств;
3) в случае газовой фазы - барботажем через слой жидкости.
Методы диспергирования обычно значительно уступают методам конденсации по дисперсности полученных систем (а ≥ 10-6 м).
Метод пептизации – переход в коллоидный раствор осадков, образующихся при коагуляции. Пептизация может происходить в результате промывания осадка или под действием специальных веществ – пептизаторов. Пептизация происходит за счет удаления из осадка коагулирующих ионов или в результате адсорбции пептизатора коллоидными частицами осадка.
Явление пептизации имеет большое значение в технике при переведении различных осадков в коллоидные растворы. Однако иногда оно играет отрицательную роль, затрудняя технологические процессы.
Очистка коллоидных систем
Удаление из коллоидных растворов низкомолекулярных примесей, которые часто обладают астабилизирующим действием, может быть осуществлено с помощью диализа, электродиализа и ультрафильтрации.
Диализ – самый простой метод очистки коллоидных систем. Простейший диализатор представляет собой мешочек из полупроницаемого материала, в который заливается диализируемая жидкость. Мешочек опускается в сосуд с водой. При диализе растворенное кристаллическое вещество проходит через мембрану, а коллоидные частицы, неспособные проникать через полупроницаемую перегородку, остаются в виде очищенного коллоидного раствора. Природа перегородки может быть различной (бычий пузырь, пергамент, коллодий, целлофан и др.)
Электродиализ – усложненный вариант диализа. Если примеси являются электролитами, их переход через перегородку может быть ускорен путем наложения на диализируемую жидкость электрического поля. Электродиализ целесообразен при небольших концентрациях примесей в коллоидном растворе (при больших концентрациях происходит сильный разогрев золя).
Ультрафильтрация – диализ, проводимый под давлением. Ультрафильтрация чаще используется не для очистки коллоидных растворов, а для их концентрирования. При ультрафильтрации происходит лишь повышение концентрации дисперсной фазы, а состав дисперсионной среды остается практически постоянным. Однако если после частичной ультрафильтрации полученный золь разбавить чистым растворителем до прежнего содержания дисперсной фазы, он будет содержать меньше низкомолекулярных продуктов.
45Аналитическая химия – это наука о методах определения химического состава вещества и его структуры. Предметом аналитической химии является разработка методов и практическое выполнение анализов, исследование теоретических основ аналитических методов, к которым относятся: изучение форм существования элементов и их соединений в различных средах и агрегатных состояниях, определение состава и устойчивости координационных соединений, оптических, электрохимических и других характеристик вещества, исследованиескоростей химических реакций, определение метрологических характеристик методов.
Теоретическую основу аналитической химии составляют фундаментальные законы естествознания: периодический закон Д.И. Менделеева, законы сохранения энергии и массы вещества, законы постоянства состава, действующих масс и т.д. Аналитическая химия тесно связана с физикой, неорганической, физической, коллоидной химией, электрохимией, термодинамикой, теорией растворов,метрологией. В современной аналитической химии используются учения о координационных соединениях, квантово-химических методахи теории строения вещества, о кинетике реакций.
Аналити́ческая хи́мия — раздел химии, изучающий химический состав и отчасти структуру веществ; имеет целью определение химических элементов или групп элементов, входящих в состав веществ.[1] Предмет её как науки — совершенствование существующих и разработка новых методов анализа, поиск возможностей их практического применения, исследование теоретических основ аналитических методов.
В зависимости от задач, аналитическая химия подразделяется на качественный анализ, нацеленный на определение того, что или какие вещества, в какой форме находится в образце, и количественный анализ, нацеленный на определение сколько данного вещества (элементов, ионов, молекулярных форм и др.) находится в образце.
Определение элементного состава материальных объектов называют элементным анализом. Установление строения химических соединений и их смесей на молекулярном уровне называют молекулярным анализом. Одним из видов молекулярного анализа химических соединений является структурный анализ, направленный на исследование пространственного атомного строения веществ, установление эмпирических формул, молекулярных масс и др. В задачи аналитической химии входит определение характеристик органических, неорганических и биохимических объектов. Анализ органических соединений по функциональным группам называют функциональным анализом.
История[править | править вики-текст]
Аналитическая химия существует с тех пор, как существует химия в современном её смысле, а многие применяемые в ней приемы относятся к ещё более ранней эпохе, эпохе алхимии, одной из главных задач которой было именно определение состава различных природных веществ и изучение процессов их взаимных превращений. Но, по мере развития всей химии в целом, значительно совершенствовались и применяемые в ней методы работы, и, наряду со своим чисто служебным значением одного из вспомогательных отделов химии, аналитическая химия в настоящее время имеет значение совершенно самостоятельного отдела химического знания с очень серьезными и важными задачами теоретического характера. Очень важное влияние на развитие аналитической химии имела современнаяфизическая химия, обогатившая её рядом совершенно новых методов работы и теоретических оснований, к числу которых нужно отнести учение о растворах, теорию электролитической диссоциации, закон действующих масс (см.Химическое равновесие) и всё учение о химическом сродстве.[1]
46УСЛОВИЯ ПРОВЕДЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ
Достигнуть нужного эффекта конкретной аналитической реакции возможно лишь при условии строгого соблюдения оптимальных условий ее проведения. Оптимальные условия определяются концентрацией реагирующих веществ, рН среды, температурным режимом, способом проведения реакции, приемом наблюдения, учетом влияния посторонних ионов. Рассмотрим некоторые примеры.
Чтобы образовался какой-либо осадок, надо с помощью определенного реагента создать в реакционной среде условия, при которых получается пересыщенный раствор. Заметим, не всегда для создания условий пересыщения раствора ионами, образующими в дальнейшем осадок, следует прибавлять избыток реагента. В присутствии избытка реагента реакция может не заканчиваться на стадии образования осадка, а протекать далее. При этом ожидаемый эффект реакции будет либо «смазан», либо вообще отсутствовать.
Например, при обнаружении ионов Hg2+ с помощью KI по реакции
Hg(N03)2 + 2KI 4HgI2 + 2KN03
в случае избытка реагента KI вместо осадка ярко-красного цвета Hgl2 образуется растворимое комплексное соединение, окрашивающее раствор в бледно-желтый цвет: HgI2 + 2KI —+ K2[HgI4]. Влияние рН среды наглядно видно при проведении реакций обнаружения К+ в соединениях КС1 и КОН с помощью реагента гексанитрокобальтата натрия:
2KC1 + Na3 [Со(М02)б] 3KOH + Na3 [Co(N02)6] ? ->4 K2Na [Со (N02)6] +2NaCI, -1 Co (ОН) з + 3KN02 + 3NaN02
В первом случае получается ожидаемый осадок желтого цвета K2Na [Со (N02)6], а во втором — черного цвета гидроксид кобальта Со(ОН)3, образующийся в результате разрушения реагента ОН~-ионами. Чтобы обнаружить ионы К+ в соединениях КОН, K2S и KI с помощью гексанитрокобальтата натрия, потребуется предварительно удалить ионы ОН", S ~ и 1~ (гидроксид-ионы — реакцией нейтрализации, а сульфид- и иодид-ионы — например, осаждением в виде малорастворимых солей Ag2S и Agl). В противном случае реагент будет разрушаться перечисленными анионами. Оптимальные условия проведения этой реакции: рН 3—7, довольно концентрированный раствор, нагревание, отсутствие ионов NH4+ которые дают такой же желтый кристаллический осадок (NH4)2Na [Co(N02)6].
119
Г Л А В А 7
СИСТЕМАТИЧЕСКИЙ И ДРОБНЫЙ КАЧЕСТВЕННЫЙ АНАЛИЗ
Для проведения качественного анализа неорганического вещества, как правило, его переводят в раствор, и практически задача сводится к обнаружению катионов и анионов. Очень редко в анализе необходима идентификация вещества, т. е. подтверждение уже известного состава с помощью химических реакций и определение присущих веществу физических констант (ч-астота и интенсивность полос поглощения в различных спектрах, плотность и т. д.). В этом случае и если состав анализируемого раствора несложен, можно проводить анализ дробным методом. Если имеют дело с неизвестным и сложным составом анализируемого раствора, то для обнаружения входящих в него катионов и анионов применяют систематический метод анализа.
Дробный метод анализа опирается на Периодическую систему Д. И. Менделеева. Все катионы делят на 3 группы, включающие соответственно s-, р- и d-элементы. В идеальном случае в дробном анализе применяют специфические реакции, которые позволяют обнаружить один ион в присутствии всех остальных ионов в любой последовательности в отдельных порциях анализируемого раствора. Как было уже указано, специфических реакций известно немного. Поэтому в дробном методе анализа качественные характерные реакции проводят после предварительной маскировки или удаления мешающих ионов перечисленными выше методами.
Систематический метод анализа основан на том, что сначала с помощью групповых реагентов разделяют смесь ионов на группы и подгруппы, а затем уже в пределах этих групп и подгрупп обнаруживают каждый ион характерными реакциями. Групповыми реагентами действуют на смесь ионов последовательно и в строго определенном порядке.
Таким образом, при систематическом ходе анализа прибегают к обнаружению индивидуальных ионов после того, как все другие ионы, реагирующие с избранным реагентом, будут отделены от них действием групповых реагентов.
Название систематического метода анализа определяется групповыми реагентами. Классическим методом анализа катионов является сероводородный, основанный на образовании сульфидов или сррнистых соединений при взаимодействии солей с сероводородом (табл. 7.1). В этом методе из смеси катионов последовательно выделяют I группу действием 2 М раствора НС1, затем II группу — действием H2S при
120
Ag+ Pb2+, 1 подгруппа: Al3+, Ва2+, Sr2+, Na+K+Nrtf
Hgl+ Cr3+, Cu2+, Cd2+ Ca2+ Mg2+
Fe2+, Fe3+, Bi111 ' ё
Hg2+,Mn2+,Zn2+,
Co2+, Ni2+
2 под-группа:
Asm,
Asv,
Sbin,
Sbv,
Sn2 + ,
SnlV
В некоторых учебниках и учебных пособиях принята обратная нумерация групп катионов.
Групповые реагенты применяют в анализе смеси анионов лишь в предварительных испытаниях, имеющих целью установить присутствие или отсутствие той или иной группы анионов.
Групповые реагенты на анионы — следующие. •
1. Реагенты, разлагающие вещества с выделением газов (разбавленная НС1 и H2S04).
2. Реагенты, выделяющие анионы из растворов в виде труднорастворимых осадков: ВаС12 в нейтральной среде; AgN03 в 2 М HN03.
3. Реагенты-восстановители — KI-
4. Реагенты-окислители — КМп04, концентрированная
H2S04, 12 в KI.
По наиболее простой классификации, основанной на растворимости солей бария, анионы делят на две группы. К первой группе относят анионы, образующие растворимые в воде соли бария: СГ, Вг~, I", CN~. SCN~, S2", N02 , NOT, МпОг, СН3СОО~, СЮГ, С10Г, СЮ . Ко второй группе относят анионы, образующие малорастворимые в воде соли бария: F", СО?", С20?-, SO§~, S20!", SO?", S2082" SiOl", CrOl", CrjO?- POJ-, As04", AsOi".
Качественный анализ неорганических и органических веществ существенно различается из-за их специфических свойств. Химические методы анализа органических веществ делятся на элементный, функциональный и молекулярный. Элементный анализ — обнаружение элементов, входящих в молекулу органического вещества (С, Н, О, N, S, Р, С1 и др.). В большинстве случаев органическое вещество предварительно разлагают, продукты разложения растворяют и, применяя методы неорганического качественного анализа, обнаруживают интересующие элементы. Например, при обнаружении азота пробу сплавляют с металлическим калием, и образующийся KCN дает с FeS04 гексацианоферрат калия:
6KCN + FeS04 v K4[Fe(CN)6]+K2S04.
При добавлении ионов Fe3+ образуется осадок берлинской лазури Fe4 [Fe (CN)6] (аналитический сигнал на присутствие азота).
Функциональный анализ — определение типа функциональной группы, входящей в исследуемое вещество. Реакции, используемые для определения функциональной группы,' отличаются от реакций катионов и анионов, в неорганическом анализе, хотя их часто используют на конечном этапе анализа. Например, нелетучие вторичные спирты при нагревании с серой дают H2S, который обнаруживают по черному осадку PbS:
>CHOH + S v CO + H2S,
H2S + Pb(N03)2 » PbS|+2HN03.
Дата добавления: 2014-12-30; просмотров: 2381; Мы поможем в написании вашей работы!; Нарушение авторских прав |