
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
PH воды
Для удобства, концентрации [H+] и [HO-] выражают в виде водородного показателя pH и гидроксильного показателя pOH. pH иpOH - это отрицательные десятичные логарифмы концентраций [H+]и [HO-] (правильнее использовать не концентрацию, а активность) соответственно:
pH = -lg[H+]
pOH = -lg[OH-]
Прологарифмируя уравнение [H+] • [HO-] = 10-14 получим:
lg[H+] + lg[OH-] = -14
-lg[H+] - lg[OH-] = 14
pH + pOH = 14
Получившаяся сумма pH и pOH, также как и произведение, которое логарифмировали, является постоянной и равна 14, так если pH=3 тоpOH=11 (pH и pOH могут быть и отрицательными, и если pH=-1тогда pOH=15).
В зависимости от pH растворы делят на нейтральные, кислые и щелочные. При pH=7 раствор нейтральный, при pH<7 - кислый, приpH>7 - щелочной.
От pH раствора очень сильно зависит протекание многих химических реакций, как на уровне процессов проводящихся в лаборатории и на производстве, так и на уровне реакций в живых организмах, поэтому химикам и биологам с водородным показателем иметь дело приходится очень часто. Все обитатели природных вод и почв адаптированы к определенному водородному показателю, и в случаи его изменения могут погибнуть. Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Отчасти это связано с тем, что под действием ионов H+ и OH- многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение рН. От величины водородного показателя почвенного раствора зависит урожайность различных культурных растений. На кислых почвах с pH=5-5,5 не развиваются проростки ячменя, но хорошо развивается картофель.
37В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита. Возможность и характер протекания гидролиза определяется природой соли:

|

|

|

|

|

|
В первом случае гидролиз идет по катиону и pH < 7, во втором по аниону – pH > 7, а в третьем – по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Константа равновесия для первого случая

|
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда

|
Умножив числитель и знаменатель на [OH–], получим
|
Аналогично для гидролиза по аниону
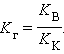
|
Для гидролиза по катиону и аниону одновременно
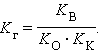
|
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
|
C – концентрация соли в моль/л.
Для малых значений αг

|
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:

|

|

|
Распространенной ошибкой при составлении уравнений гидролиза является использование сразу более одной молекулы воды.
Сравните:
· Правильно:
|
· Неправильно:
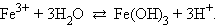
|
Гидролиз хлорида железа идет преимущественно по первой ступени из-за накапливания ионов H+ и недостатка гидроксильных ионов, необходимых для протекания реакции гидролиза (  ничтожно мала).
ничтожно мала).
В результате гидролиза многозарядных катионов образуются основные соли Fe(OH)Cl2, Fe(OH)2Cl, а гидролиз многозарядных анионов приводит к образованию кислых солей (NaHCO3, NaH2PO4).
Явление гидролиза следует учитывать при приготовлении растворов. Для предотвращения гидролиза растворы солей, подвергающиеся гидролизу по катиону, необходимо подкислять.
38Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты с сопряженным основанием (напр., СН3СООН и CH3COONa — ацетатный буфер) или слабого основания и сопряженной кислоты (напр., NH3 и NH4CI — аммиачный буфер).[1] Величина рНбуферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических и биохимических процессах.
Буферные растворы имеют большое значение для протекания реакций в живых организмах. Например, в кровипостоянство водородного показателя рН (химический гомеостаз) поддерживается тремя независимыми буферными системами: бикарбонатной, фосфатной и белковой. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле:  , где
, где  это отрицательный десятичный логарифм от константы диссоциации кислоты
это отрицательный десятичный логарифм от константы диссоциации кислоты  .
.
По сути  .
.
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основноеравновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемогло-биновая.
Бикарбонатнаябуферная система– мощная и, пожалуй, самая управляемая система внеклеточной жидкости икрови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:

Для данной буферной системы величину рН в растворе можно выразить через константу диссоциации угольной кислоты (рКН2СО3) и логарифм концентрации недиссоциированных молекул Н2СО3 и ионов HCO3–:

Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О <=> Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:

где K1– «кажущаяся» константа диссоциации Н2 С О3 ; [СО2(р)] – концентрация растворенного СО2.
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышаетконцентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрацияН2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуютионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме кровинекоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой.
39Дисперсные системы образования из двух или большего числа фаз (тел) с сильно развитой поверхностью раздела между ними. В Д. с. по крайней мере одна из фаз - дисперсная фаза - распределена в виде мелких частиц (кристалликов, нитей, плёнок или пластинок, капель, пузырьков) в другой, сплошной, фазе - дисперсионной среде. Д. с. по основной характеристике - размерам частиц или (что то же самое) дисперсности (определяемой отношением общей площади межфазной поверхности к объёму дисперсной фазы) - делятся на грубо (низко) дисперсные и тонко (высоко) дисперсные, или коллоидные системы (коллоиды). В грубодисперсных системах частицы имеют размер от 10-4 см и выше, в коллоидных - от 10-4-10-5 до 10-7 см. По агрегатному состоянию дисперсионной среды различают газодисперсные системы -аэрозоли (туманы, дымы), пыль; жидкодисперсные - золи, суспензии, эмульсии, пены; твёрдодисперсные - стеклообразные или кристаллические тела с включениями мельчайших твёрдых частиц, капель жидкости или пузырьков газа (см. табл.). Пыль, суспензии, лиофобные эмульсии (см. Лиофильные и лиофобные коллоиды) - грубодисперсные системы; как правило (при наличии разности плотностей), они седиментационно неустойчивы, т. е. их частицы оседают под действием силы тяжести или всплывают. Золи - типичные высокодисперсные коллоидные системы, частицы дисперсной фазы которых (мицеллы) участвуют в броуновском движении и потому седиментационно устойчивы. Жидкие и твёрдые пены, состоящие из газовых ячеек-пузырьков, разделённых тонкими прослойками непрерывной фазы, представляют особую группу структурированных ячеистых систем (см. ниже).
По интенсивности молекулярного взаимодействия фаз различают лиофильные и лиофобные Д. с. В лиофильных системах молекулярное взаимодействие между фазами достаточно велико и удельная свободная поверхностная энергия (поверхностное натяжение) на межфазной границе очень мала. Лиофильные системы образуются самопроизвольно (спонтанно) и имеют предельно высокую дисперсность. В лиофобных системах взаимодействие между молекулами различных фаз значительно слабее, чем в случае лиофильных систем; межфазное поверхностное натяжение велико, вследствие чего система проявляет тенденцию к самопроизвольному укрупнению частиц дисперсной фазы (см.Коагуляция и Коалесценция). Обязательное условие существования лиофобных Д. с. - наличие стабилизаторов, веществ, которые адсорбируются на поверхности раздела фаз и образуют защитные слои, препятствующие сближению частиц дисперсной фазы.
Д. с. могут быть бесструктурными (свободнодисперсными) и структурированными (связнодисперсными). Структурированные Д. с. пронизаны сеткой-каркасом из соединённых между собой частиц (капель, пузырьков) дисперсной фазы, вследствие чего обладают некоторыми механическими свойствами твёрдых тел (подробнее см. Дисперсная структура, Гели). Характерная особенность Д. с. - высокая свободная энергия как следствие сильно развитой межфазной поверхности; поэтому Д. с. обычно (кроме лиофильных Д. с.) термодинамически неустойчивы. Они обладают повышенной адсорбционной способностью, химической, а иногда и биологической активностью. Д. с. - основной объект изучения коллоидной химии.
Д. с. широко распространены в природе, технике и быту. Примерами Д. с. могут служить горные породы, грунты, почвы, дымы, облака, атмосферные осадки, растительные и животные ткани; строительные материалы, краски, моющие средства, волокнистые изделия, важнейшие пищевые продукты и многие др.
Классификация дисперсных систем по агрегатному состоянию фаз
| Дисперсионная среда | Дисперсная фаза | ||
| газовая | жидкая | твёрдая | |
| Газовая | Дисперсные систе- мы не образуются | Туманы | Дымы, пыль |
| Жидкая | Пены | Эмульсии | Суспензии |
| Золи (коллоидные "растворы")* | |||
| Твёрдая | Аэрогели (пористые тела) | Жидкие включения в твёрдых телах | Твёрдые золи (рубиновое стекло) |
* Предельно высокодисперсные системы (золи) иногда трудно классифицировать по агрегатному состоянию дисперсной фазы.
Дисперги́рование — тонкое измельчение твердых тел или жидкостей, в результате чего получают порошки, суспензии, эмульсии (эмульги́рование, или эмульга́ция). При диспергировании твердых тел происходит их механическое разрушение.
Дата добавления: 2014-12-30; просмотров: 384; Мы поможем в написании вашей работы!; Нарушение авторских прав |

