
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кешенді қосылыстардың құрылысы. Термодинамикалық және кинетикалық тұрақтылықтардың айырмашылығы
Кешенді қосылыстардың жіктелуі мен аталуы.Координациялық қосылыстардың кешенді ионының заряды бойынша оларды катионды, анионды және бейтарап деп жіктейді. Орталықтағы оң ионның айналасына бейтарап молекулалар (Н2О, NH3 т.б) шоғырланғанда катионды кешенге жатады:[Al(H2O)6]+3Cl3, [Zn(NH3)4]+2Cl2. Егер кешентүзушіні теріс зарядты аниондар: Cl-, F-, SO  , OH-, CN- т.б қоршаса анионды кешенге жатады: K2[AlF4]-2, Na[Al(OH)4]-1, K2[SO4]-2, Li[Al(OH)4]-1. Егер кешентүзушінің айналасына өз ионымен қоса бейтарап молекулалардан тұратын лигандтар шоғырланса бейтарап кешендер түзіледі: [
, OH-, CN- т.б қоршаса анионды кешенге жатады: K2[AlF4]-2, Na[Al(OH)4]-1, K2[SO4]-2, Li[Al(OH)4]-1. Егер кешентүзушінің айналасына өз ионымен қоса бейтарап молекулалардан тұратын лигандтар шоғырланса бейтарап кешендер түзіледі: [  (
(  )
)  ]0 Бұл жіктеу бойынша кешенді қосылыстың зарядтан басқа сипаты айқындалмайды.
]0 Бұл жіктеу бойынша кешенді қосылыстың зарядтан басқа сипаты айқындалмайды.
Кешентүзушінің қызметін периодтық кестедегі кез келген элемент атқара алады. Мысалы, анионды кешендердің кешентүзушісі бейметалдарды алайық. K3[PO4]-3, K[PF6]-1. Десек те типтік металдық, сілтілік, сілтілік жер элементтері бейорганикалық лигандтармен кешен түзуге онша бейім келмейді. Кешентүзушімен әлсіз байланысқан олардың қосылыстары көбіне катионды болып келеді: [Ca(NH3)6]Cl2. Нағыз координациялық қосылыстарды түзгіштер d және f элементтердің қосылыстары. Екідайлық қабілеті бар элементтер катионды да, анионды да кешендер түзе береді:[Al(H2O)6]+3Cl3, K[Al(OH)4]-1
Лигандтар бойынша жіктеу кешендердің табиғатын тануға мүмкіндік береді. Алдымен құрамында молекулалық монодентатты лигандтарды қарастырайық, оларға аквокешендер, амминкешендер (қысқаша амминдер), металл карбонильдері жатады. Құрамына лигандтар ретінде су молекуласы ғана енетін болса аквокешендер [Co(H2O)4]×SO4×H2O, аммиактан амминкешендер [Co(NH3)6]Cl2, көміртек (II) оксидінен карбонилдер түзіледі.
Лигандтары қышқыл қалдықтары, басқа да аниондар болып келетін кешендердің жалпы аталуы ацидокешендер. Оларды дәлірек лигандтарының түріне орай фторо [AlF6]3-, бромо [AuBr4]- циaно [Au(CN)6]- йодо [TiI4]- кешендер деп те атайды. Егер құрамына ОН- иондары енсе гидроксокешендер шығады: K2[Be(OH)4], Na2[Zn(OH)4] т.т.
Галогендердің молекулалары бос галогендермен және күкіртпен толықса полигалогенидтер K[I×I2] немесе K[I3] және полисульфидтер K2S×S=K2[S2] шығады.
Жоғарыда сөз етілген кешен түзушінің құрамына бір ғана кіретін моноядролы кешендермен қоса бірнеше атом енетін полиядролы кешендер де болады:
| [(NH3)5Co-OH-Co(NH3)5]Cl5, |   OH OH
|
  [(NH3)4Co Co(NH3)4]Cl4 [(NH3)4Co Co(NH3)4]Cl4
| |
| OH |
Екі ядроның арасын байланыстыратын лиганд (ОН) көпірше деп аталады.
Халықаралық атаулар жүйесінің талаптарына сай кешенді қосылыстар құрамындағы теріс зарядталған бір элемент атомының лигандтарының атауының түбірінің соңына «о» деген дауысты дыбыс жалғанады. Мысалы, F-(фторо), Cl-(хлоро), O-2 (оксо) дәстүр бойынша күкірттің анионы S-2 (тио) т.б. Күрделі құрамды аниондардың «ат» жұрнағының соңына «о» дыбысын қосады: SO  (сульфато), NO
(сульфато), NO  (нитрато), CO
(нитрато), CO  (карбонато). Ал негіздерге тән гидроксид ионы кешенді қосылыстары лигандына айналғанда қысқартып, гидроксо сөзін қолданады. Егер лигандтар бейтарап бөлшек түрінде болса негізінен олардың көпшілікке таныс халықаралық атаулары аталады: H2O (акво), NH3(аммин), CO(карбонил), CS(тиокарбонил), NO(нитрозил) т.б.
(карбонато). Ал негіздерге тән гидроксид ионы кешенді қосылыстары лигандына айналғанда қысқартып, гидроксо сөзін қолданады. Егер лигандтар бейтарап бөлшек түрінде болса негізінен олардың көпшілікке таныс халықаралық атаулары аталады: H2O (акво), NH3(аммин), CO(карбонил), CS(тиокарбонил), NO(нитрозил) т.б.
Кешенді қосылыстардың халықаралық аталымдары бұрыннан білетін тұздардың атаулар жүйесіне ұқсайды. Катион-анион жүйесін сақтай отырып, ішкі сфералардағы бөлшектердің атауы мен санын көрсете отырып, соңынан басына қарай атай бастайды.
Сыртқы сфералы бейтарап кешенді қосылыстардың атауы былайша құрылады: шаршы жақшада орналасқан құраушылардың алдымен сандары көрсетілген теріс зарядты лигандтар, одан соң бейтарап лигандтар, ақырында кешен түзушінің өзі қосылып бүкіл атау бірге аталады. Мысалы, [Pt(NH3)2Cl2] дихлородиамминплатина(0), мұндағы 0 – кешенді қосылыстың бейтараптылығын көрсетеді.
Катионды кешендердің атауы катион-аниондық реттілікті сақтайды: алдымен катиондағы лигандтарды солдан оңға қарай санын көрсете отырып атап, кешентүзушінің атау септіктегі нұсқасын сақтап, жақшада рим сандарымен тотығу дәрежесін көрсетіп, сыртқы сферадағы анионның атауын ілік септікте береді. Мысалы, [Al(H2O)6]Cl3 гексааквоалюминий(III)хлориді немесе гексааквоалюминийтрихлориді, [Co(NH3)4Cl]SO4 монохлоротетраамминкобальт(III)сульфаты, [Co(NH3)6](SO4)Cl гексаамминкобальт(III)хлорид-сульфаты
Кешенді қосылыстардың тұрақтылығы.Координациялық қосылыстар басқа да электролиттер сияқты сулы ортада диссоцияцияға ұшырайды. Мұнда оңай жүретін үдеріс ішкі және сыртқы сфералардың иондарға диссоциациялануы: Мысалы, К2[HgI4] кешенді тұзды суға салысымен күшті электролиттерінде бірден катион мен анионға бөлінеді:
K2[HgI4]=2K++[HgI4]2-
Бұдан шыққан кешенді ион тетраиодогидраргаты[HgI4]2- әлсіз электролит ретінде біртіндеп диссоциациялана бастайды:
| [HgI4]2-« [HgI3]-+I- | K  = = 
|
| [HgI3]- «[HgI2]0+I- | К  = = 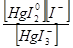
|
| [HgI2]0«[HgI]++ I- | К  = = 
|
| HgI+«Hg2++ I- | К  = = 
|
Әрбір сатыға сай олардың сатылы тұрақтылық константасын жазып көрсетуге болады. Олардың бәрін бірге кешенді ионның жалпы тұрақтылық константасы ретінде көрсету үшін бәрін өзара көбейту қажет: К  · К
· К  ·К
·К  ·К
·К  =К
=К  =
= 
Ескерте кетер жағдай: кешенді бөлшектер сатылап диссоциацияланғандықтан, әрі әрбір келесі саты алдындағыдан қиынырақ өтетіндіктен үдеріс аяғына дейін толық жүреді, яғни
[HgI4]2-↔ Hg2++ 4I-
тепе-теңдікке дейін бәрі бірдей Hg2++ 4I- иондарға түгелдей ыдырап кете алмайды. Ерітінділердегі тұздардың ерігіштік көбейтіндісі сияқты Ек тұрақсыздық константасы да неғұрлым кіші мәнге ие болған сайын ол тұрақты бола түседі. Оның көбірек диссоциациялану үдерісі бірінші сатыда байқалады, одан кейінірек жүретін екінші, үшінші сатылардағы бөлшектердің диссоциациялануы біртіндеп кеми береді. Міне, солардың ең соңғы сатысындағы жиынтық көрсеткіш кешенді ионның тұрақтылық константасын көрсетеді.
Кешенді ион химиялық әрекеттесу кезінде реагенттердің әсерінен ерігіштігі тым аз немесе диссоциацияланатын қосылыс түзсе онда түгелдей басқа заттарға айналып кетеді. Бұл әрекеттесулер әсер етуші массалар заңына сай өтеді. Бастапқы кешендегі лигандтар байланысы берігірек ұстасып жаңа бөлшектерге ауысатын жаққа ығысады. Оған мысал ретінде диамминкүміс(II) ионының азот қышқылының әсерінен ыдырап түзілетін жаңа кешенді ион аммоний NH 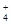 және аз еритін күміс хлоридіне айналуын келтіруге болады:
және аз еритін күміс хлоридіне айналуын келтіруге болады:
[Ag(NH3)2]Сl+2HNO3=2NH4NO3+AgCl¯
Кешендегі ионның құрамындағы лиганд аммиак молекуласы (Ктұр=4·10-7) протон қосып алып одан да берік аммоний ионына NH 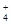 (Ктұр=6·10-10) айналады. Жоғарыда талданған дикалий тетрайодогидраргиратына күкіртсутекпен әсер етсе, ол да ыдырап, өте аз еритін сынап сульфидін HgS (Ek=10-53)түзеді:
(Ктұр=6·10-10) айналады. Жоғарыда талданған дикалий тетрайодогидраргиратына күкіртсутекпен әсер етсе, ол да ыдырап, өте аз еритін сынап сульфидін HgS (Ek=10-53)түзеді:
K2[HgI4]+H2S=HgS¯+2KI+2HI
Кинетикалық тұрақтылық. Лигандамен алмасу жылдамдылығы термодинамикалық тұрақтылықпен байланысты емес. Мысалы [СO(NH3)6]3+ кешенін қышқылды ерітіндіде бірнеше күн сақтауға болады.
[СO(NH3)6]3+ + 6H3O+ = [СO(NH3)6]3+
Бұл реакцияның тепе-теңдік константасы 1025 мәніне тең.
Кешеннің инерттілігі мен тұрақсыздығы жайында екі жағдай қарастырылады. Біріншіден, тек қана инертті кешендердің жеке изомерлерін бөліп айқындауға болады. Екіншіден оған инертті кешендерді синтездеу әдісін таңдау алдында мән беру керек.
Лигандалармен алмасудың әр-түрлі жылдамдылықтары жайындағы көрнекі көзқарас кешенді ионға жандану уақытын береді. 4.49 суретте гексааква-иондарының жандану уақыты берілген. Бұл иондар таңбаланған атомдары бар судың су ерітіндісіне айналу тәжірибесі кезінде табылған.
d- элементтер кешенінің инерттілігі мен тұрақсыздығын кристалды жазықтық теориясымен түсінуге болады. Реакция нуклеофильді орын басу механизмі бойынша жүреді. Саты бойынша мұндай реакциялар диссоциативті, ассоциативті механизмдер мен ішкі алмасу механизмдерін бөледі. Ассоциативті және диссоциативті механизмдердің ішкі алмасу механизмнен айырмашылығы аралық қосылыс-интермедиат түзілуінде.
Диссоциативті механизм реакциялық реттілікке сәйкес келеді. Ал ол аз координациялық санымен MLn аралық қосылысының түзілуімен түсіндіріледі.
MLnХ → MLn+Х, MLn+Ү → MLnҮ
Ассоциативті механизмге MLnХҮ интермедиатының бірнеше координациялық саны бар сатысы жатады.
MLnХ +Ү→ MLnХҮ, MLnХҮ → MLnҮ+Х
Бұл механизм d8 (Pt (II), Pd (II), Ir (I)) орталық ион конфигурациясы бар жазық-квадратты комплекс реакцияларында жүзеге асады. Мысал ретінде квдратты кешендегі 14CN- ионының лигандтармен алмасуын айтуға болады.
Бірінші сатыда кешентүзгіш ионымен қосымша лигандтың координациясы жүреді:
[Ni(CN)4]2- + 14CN- → [Ni(CN)414CN]3-
содан соң лиганд ыдырап:
[Ni(CN)414CN]3-→[Ni(CN)314CN]2- + CN-
Ішкі алмасу механизмі бір сатылы болып келеді:
MLnХ +Ү→ Х... MLn...Ү...→ MLnҮ+Х
Бұл механизмде аралық өнім түзілмейтін Ү реагентімен Х тобын біртіндеп ығыстыруы жүреді. Ішкі алмасу механизмі ең көп таралған.
Транс әсер ету эффектісі. Квадратты кешендердің реакция кинетикасының спецификалық көрінісінің бірі лиганданың реакция жылдамдығына әсер етуі болып табылады. Мұндай эффекті транс-әсер ету деп аталады. Ол орталық атомның лигандамен байланысы әлсіреген кезде пайда болады. Транс әсер ету жоғары болған сайын байланыс бәсеңдеу түсіп, орын басу тез болады. Лигадттардың транс әсер етуі келесідей қатармен орналасады:
ОН-<NH3<Cl-<Br-<CN-, CO, CH3-<I-<SCN-<PR3<H-
Дата добавления: 2015-01-01; просмотров: 1499; Мы поможем в написании вашей работы!; Нарушение авторских прав |