
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретические основы. Коррозией называется самопроизвольное разрушением металлов и сплавов под действием окружающей среды
Коррозией называется самопроизвольное разрушением металлов и сплавов под действием окружающей среды. Характер и скорость коррозии определяется природой металла, составом среды, а также наличием примесей в металле и структурой его поверхности. В зависимости от природы среды, в которой находится металл, коррозию условно делят на два вида - химическую и электрохимическую.
Химическая коррозия протекает в среде неэлектролита, т.е. в сухих газах и парах при высокой температуре, когда невозможна конденсация влаги на поверхности металла (газовая коррозия), или в жидком неэлектролите (например, нефтепродукты, в которых присутствуют хлор- или серосодержащие вещества).
Электрохимическая коррозия происходит в средах, проводящих электрический ток - в растворах электролитов, во влажной атмосфере, в почве и т.п. Согласно теории микрогальванических элементов электрохимическая коррозия объясняется тем, что на отдельных участках металлической поверхности возникают разные по величине электродные потенциалы. Причиной этого является неоднородность поверхности: металлические и неметаллические примеси, оксидные и солевые плёнки, загрязнения, контакт разных металлов и т.д.
При контакте двух разных металлов или при наличии металлической примеси катодом является менее активный металл, у которого больше электродный потенциал. Более активный металл, поляризуясь анодно, окисляется и подвергается разрушению:
Мео - n 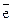 = Men+.
= Men+.
Катодный процесс при электрохимической коррозии, называемый деполяризацией, представляет собой восстановление окислителя, содержащегося в электролите.
В кислой среде это преимущественно катионы водорода:
2Не+ + 2 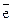 = Н2 (водородная деполяризация).
= Н2 (водородная деполяризация).
В нейтральной и щелочной среде идёт восстановление растворённого кислорода:
О2 + 2Н2О + 4 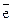 = 4ОН- (кислородная деполяризация).
= 4ОН- (кислородная деполяризация).
Пример.Написать уравнения процессов, происходящих при коррозии железа, содержащего примеси меди, в разбавленной соляной кислоте.

 Ответ. В местах контакта железа с включениями меди в растворе соляной кислоты образуются микрогальванические элементы, которые можно представить схемой:
Ответ. В местах контакта железа с включениями меди в растворе соляной кислоты образуются микрогальванические элементы, которые можно представить схемой:
(-)Fe HCl Cu(+). Исходя из положения металлов в ряду напряжений, заключаем, что железо более активно (j оFe = - 0.44 В) и в образующейся гальванопаре является анодом, а менее активная медь (j оCu = + 0.34 В) - катодом. Поэтому железо окисляется, а на катоде происходит восстановление ионов водорода:
А: Fео - 2 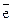 = Fe2+
= Fe2+
K(Cu): 2Не+ + 2 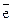 = Н2
= Н2
Суммарное уравнение: Fe + 2HCl ¾® FeCl2 + H2. Коррозии подвергается железо.
Для предупреждения коррозии и защиты от неё используются разнообразные методы: электрохимическая защита, применение химически стойких сплавов, обработка коррозионной среды, металлические и неметаллические покрытия, обработка поверхности металла. Материалами для металлических защитных покрытий могут быть как чистые металлы (Zn, Cd, Al, Ni, Cu, Cr, Ag и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их подразделяют на катодные и анодные.
Катодными называются покрытия, в которых металл покрытия менее активен, т.е. имеет более положительное значение стандартного электродного потенциала, чем защищаемый металл. Катодные покрытия на стали образуют медь, никель, олово и др. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой анодом является железо, а катодом - металл покрытия. Например, коррозия лужёного (покрытого оловом) железа при нарушении целостности покрытия во влажном воздухе описывается следующими уравнениями электродных процессов:
А: Fео - 2 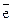 = Fe2+
= Fe2+
K(Sn): О2 + 2Н2О + 4 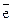 = 4ОН-
= 4ОН-
Суммарное уравнение: 2Fe + 2Н2О + О2 ® 2Fe(OH)2
4Fe(OH)2 + 2Н2О + О2 ® 4Fe(OH)3
Т.о., железо окисляется и разрушается.
Анодные покрытия образуют металлы, обладающие более отрицательными электродными потенциалами, чем защищаемый металл, например покрытие железа цинком. При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а цинк - анодом, т.е. цинк окисляется, а железо остаётся защищённым до тех пор, пока не разрушится весь материал покрытия.
Уравнения электродных процессов, происходящих при коррозии оцинкованного железа во влажном воздухе, имеют вид:
А: Znо - 2 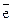 = Zn2+
= Zn2+
K(Fe):О2 + 2Н2О + 4 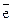 = 4ОН-
= 4ОН-
Суммарное уравнение: 2Zn + 2Н2О + О2 ® 2Zn(OH)2
Дата добавления: 2015-01-01; просмотров: 618; Мы поможем в написании вашей работы!; Нарушение авторских прав |