
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теоретические основы. К металлам относятся химические элементы с небольшим числом электронов (13) на наружном энергетическом уровне их атомов
К металлам относятся химические элементы с небольшим числом электронов (1...3) на наружном энергетическом уровне их атомов. Эти внешние электроны относительно слабо удерживаются ядром атома. Типичными металлами является большинство s-элементов (щелочные и щелочно-земельные металлы), атомы которых легко теряют валентные электроны, что отражается в низких значениях их электроотрицательности (см. приложение 1). Алюминий, галлий, бериллий, германий, олово, свинец и сурьма, как р-элементы проявляют уже амфотерные (т.е. металлические и неметаллические) свойства. В периодах, начиная с 3-его, между s-элементами и перечисленными амфотерными элементами располагаются d-элементы, для которых более характерны металлические, чем неметаллические свойства. В периодах с увеличением порядкового номера элемента, металлические свойства ослабевают, в группах, напротив, усиливаются. Если рассматривать только главные подгруппы, граница между металлами и неметаллами проходит примерно по диагонали В ¾ At. Побочные подгруппы включают только металлы.
В окислительно-восстановительных реакциях металлы выступают в роли восстановителей: Мео - n 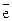 ® Men+.
® Men+.
Неметаллические простые вещества часто проявляют окислительно-восстановительную двойственность, т.е. в зависимости от условий, могут отдавать или принимать электроны, повышая или понижая степень окисления. Например:
S2-  S0
S0  S+4
S+4  S+6
S+6
 |
восстановление окисление
Для металлов характерны реакции с окислителями-неметаллами:
Mn + Cl2 ® MnCl2
3Mg + N2 ® Mg3N2
2Zn + O2 ® 2ZnO
Fe + S ® FeS
Неметаллы взаимодействуют как с окислителями, так и с восстановителями: S + O2 ® SO2 (S - восстановитель)
S + Н2 ® Н2S (S - окислитель)
Взаимодействие металлов с водой, кислотами и щелочами протекает по-разному, в зависимости от активности металлов и их свойств, определяемых положением в периодической системе.
Высокоактивные металлы (щелочные и щелочно-земельные) разлагают воду с вытеснением водорода и образованием гидроксидов:
2Na + 2H2O ® 2NaOH + H2
С растворами щелочей могут реагировать металлы, дающие амфотерные оксиды:
Zn + 2NaOH + 2H2O ® Na2[Zn (OH)4] + H2
С кислотами металлы реагируют различно в зависимости от активности самого металла и окислительных свойств кислоты.
Металлы, имеющие отрицательные значения стандартных электродных потенциалов (jо ≤ 0 В), могут вытеснять водород из растворов галогеноводородных и серной кислот.
Cr + 2HCl ® CrCl2 + H2
Mn + H2SO4 ® MnSO4 + H2
Концентрированная серная кислота при взаимодействии с металлами может восстанавливаться до S0, S2- или до S+4:
4Zn + 5H2SO4 ® 4ZnSO4 + H2S + 4H2O
Концентрированная серная кислота может при нагревании окислять металлы, которые в электрохимическом ряду, напряжений, находятся после водорода:
Сu + 2H2SO4 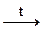 CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
Азотная кислота является сильнейшим окислителем и при взаимодействии с металлами может восстанавливаться до солей аммония и оксидов азота (N2O , NO , NO2) в зависимости от активности металла и концентрации кислоты.
4Zn + 10HNO3 разб ® 4Zn(NO3)2 + NH4NO3 + 3H2O
4Zn + 10HNO3 конц ® 4Zn(NO3)2 + N2O + 5H2O
2Cu + 8HNO3 разб ® 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 конц ® Cu(NO3)2 + 2NO2 + 2H2O
Окислительную способность азотной кислоты можно усилить, добавив к ней соляной кислоты («царская водка») или HF. Эти смеси растворяют самые пассивные металлы (Au, Pt).
Оксиды неметаллов имеют кислотный характер, а соответствующие им гидроксиды являются кислотами. Например, N2O5 - оксид азота (V), ему соответствует азотная кислота HNO3: N2O5 + H2O ® 2HNO3
Оксиды и гидроксиды металлов могут быть основными (ВаО, K2O), амфотерными (ZnO, Al2O3) и кислотными (CrO3 , Mn2O7).
Способность гидроксидов диссоциировать по кислотному типу тем больше, чем больше степень окисления атома металла и чем меньше его радиус. Поэтому в периоде с увеличением порядкового номера элемента усиливаются кислотные свойства соединений и ослабевают основные. Например:
NaOH, Mg(OH)2 - основания
Al(OH)3 - амфотерный гидроксид
H2SiO3, H3PO4, H2SO4, HClO4 - кислоты.
В группе с ростом порядкового номера элемента для однотипно построенных гидроксидов кислотные свойства ослабевают, основные - усиливаются.
Например:
HNO3, H3PO4 - кислоты
As(OH)3, Sb(OH)3 - амфотерные гидроксиды
Bi(OH)3 - основание.
Если один и тот же элемент в разных степенях окисления образует несколько оксидов и гидроксидов, то кислотные свойства усиливаются с увеличением степени окисления. Например:
Cr+2(OH)2 Cr+3(OH)3 H2Cr+6O4
основание амфотерный гидроксид кислота
Соединения основного характера взаимодействуют с веществами кислотного характера с образованием солей. Амфотерные соединения могут реагировать как с кислотными, так и с основными.
Так, основные оксиды способны взаимодействовать с образованием солей:
а)с амфотерными оксидами: Na2O + BeO 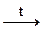 Na2BeO2 (1);
Na2BeO2 (1);
б)с кислотными оксидами: CaO + CO2 ® CaCO3 (2);
в)с кислотами: CuO + 2HCl ® CuCl2 + H2O (3);
г)с амфотерными гидроксидами:
Na2O + Zn(OH)2 ® Na2ZnO2 + H2O (4);
Характерными свойствами кислотных оксидов является их реакции:
а)с амфотерными и основными оксидами:
SiO2 + BeO 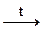 BeSiO3 (5);
BeSiO3 (5);
б)с основными гидроксидами:
SO2 + 2КОН ® К2SO3 + H2O (6);
в)с амфотерными гидроксидами:
3SO3 + 2Al(ОН)3 ® Al2(SO4)3 + 3H2O (7).
Амфотерные оксиды могут взаимодействовать как с кислотами, так и с основаниями, образуя при этом соли. Например, оксид цинка в реакции:
ZnO + 2KOH ® K2ZnO2 + H2O (8)
проявляет свойства кислотного оксида, а в реакции
ZnO + Н2SO4 ® ZnSO4 + H2O (9)
- свойства основного оксида.
Многие оксиды растворяются в воде с образованием соответствующих кислот и щелочей:
SO3 + H2O ® Н2SO4 (10),
K2O + H2O ® 2KOH (11).
В реакции (11) вступают только оксиды щелочных и щелочноземельных металлов.
К важнейшим химическим свойствами оснований относится их способность взаимодействовать с образованием солей:
а)с кислотами:
Cu(OH)2 + 2HNO3 ® Cu(NO3)2 + H2O (12);
б)с амфотерными гидроксидами:
2NaOH + Zn(OH)2 ® Na2ZnO2 + 2H2O (13);
а также с кислотными и амфотерными оксидами (реакции 6 и 8, соответственно).
Амфотерные гидроксиды могут взаимодействовать не только с основаниями, но и с кислотами:
Al(OH)3 + 3HCl ® AlCl3 + 3H2O (14).
Помимо перечисленных выше реакций, соли можно получить также следующими способами:
а)взаимодействие гидроксида (щёлочи) с солью:
2KOH + FeSO4 ® Fe(OH)2 + K2SO4 (15);
б)взаимодействие кислоты с солью:
HCl + AgNO3 ® AgCl + HNO3 (16);
в)взаимодействие соли с солью:
BaCl2 + K2SO4 ® BaSO4 + 2KCl (17).
Реакции в растворах электролитов (15, 16, 17) происходят в тех случаях, когда в числе продуктов есть слабый электролит, труднорастворимое или газообразное соединение.
За исключением солей, образованных сильными основаниями и сильными кислотами. Все соли при растворении подвергаются гидролизу:
Na2S + H2O ® NaHS + NaOH (18a)
CuCl2 + H2O ® CuOHCl + HCl (18б)
Подробнее о гидролизе солей см. [1], c.234 - 238.
С химическими свойствами соединений отдельных классов удобно знакомиться, используя таблицу 7. Приведённые в ней цифры означают возможность взаимодействия и соответствуют номеру описанных в тексте химических реакций.
Т а б л и ц а 7
Химические свойства неорганических соединений
   Классы
неоргани-ческих
соединений Классы
неоргани-ческих
соединений
| Оксиды ос- амфо кис- нов- тер- лот- ные ные ные | Ос- но- ва- ния | Амфо- терные гидро- ксиды | Кис- ло- ты | Во- да | Со- ли |
  Оксиды:
основные
амфотерные
кислотные
Основания
Амфотерные
гидроксиды
Кислоты
Вода
Соли Оксиды:
основные
амфотерные
кислотные
Основания
Амфотерные
гидроксиды
Кислоты
Вода
Соли
| - 1 2 1 - 5 2 5 - - 8 6 4 - 7 3 9 - 11 - 10 - - - | - - - | - - - - | - - - | - 10 - - - - 18 | - - - - 16 18 - |
Дата добавления: 2015-01-01; просмотров: 365; Мы поможем в написании вашей работы!; Нарушение авторских прав |