
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Типовой пример решения задачи
Задача. Какую массу оксида кальция можно получить при термическом разложении 600 г известняка, содержащего 10% примесей?
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(СаСО3)=600г W(примесей)=10% Найти: m(CаO)-? |
| 2.Составьте уравнение химической реакции | Решение: СаСО3 = СаО+СО2 |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | СаСО3 = СаО+СО2 |
| 4.Найдите массу чистого вещества (освободиться от примесей) | 600г - 100%
Х г - 10% Х=  - масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г - масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г
|
| 5.Под подчеркнутыми формулами подпишите по коэффициентам «моли» | СаСО3 = СаО+СО2 1 моль 1 моль |
| 6.Вычислите количество вещества n, которое записано в «Дано». Для расчета берите уже массу чистого вещества | 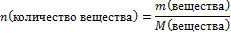 n(СаСО3) =
n(СаСО3) = 
|
| 7.Подпишите найденное n под формулой этого вещества | СаСО3 = СаО+СО2 1 моль 1 моль 5,4 моль |
| 8.Под формулой вещества, массу которого надо найти, поставьте х моль | СаСО3 = СаО+СО2 1 моль 1 моль 5,4 моль х моль |
| 9.Из полученной пропорции выразите х | 1 моль 1 моль
5,4 моль х моль
х =  –
это количество вещества n(СаО) –
это количество вещества n(СаО)
|
| 10.Зная n( CаО) найдите массу CаO | m=nM
m(CаO)= n (CаO) 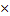 M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4 M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4  г/моль=302,4г г/моль=302,4г
|
| 11.Запишите ответ | Ответ: m(СаО)=302,4г |
Дата добавления: 2015-01-01; просмотров: 293; Мы поможем в написании вашей работы!; Нарушение авторских прав |