
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кривые кислотно-основного титрования. Выбор индикатора
В § 20.2. было показано, что значение рН в точке эквивалентности определяется прежде всего природой реагирующих кислоты и основания. Например, титрование сильной кислоты сильным основанием следует закончить в нейтральной среде (рНт.э. =7). Эксперимент показывает, что все индикаторы, имеющие рТ от 4,0 до 10,0 резко изменяют свою окраску в нейтральной среде. Для выбора индикатора строят кривые титрования.
Кривые кислотно-основного титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта.
На примере титрования сильной кислоты щелочью покажем, как, зная вид кривой титрования, выбирают индикатор для определения конца титрования.
Прежде всего, рассчитаем значение рН в различные моменты титрования и построим кривую титрования.
Предположим, что 10,0 мл раствора НСl с концентрацией 0,1 моль/л титруют раствором NaOH той же концентрации. Для простоты будем пренебрегать разбавлением титруемого раствора в ходе титрования. Поскольку растворы взяты в одинаковых концентрациях, то 1 мл кислоты эквивалентен 1 мл щелочи (потсоличеству растворенного вещества эквивалента).
До начала титрования [Н+] = 0,1 моль/л, следовательно, рН = 1. По мере титрования концентрация ионов Н+ убывает, а концентрация ионов ОН- возрастает. Если добавить 9,0 мл щелочи, то непрореагировавшей кислоты останется 1,0 мл, т.е. ее концентрация уменьшится в 10 раз и станет равной 10-2 моль/л, так что рН = 2.
Если к титруемому раствору прибавить 9,9 мл NaOH, то концентрация свободной НСl уменьшится еще в 10 раз, т.е. до 10-3 моль/л, а рН раствора возрастет приблизительно до 3. При добавлении 9,99 мл NaOH неоттитрованный остаток НСl составит 0,01 мл, что соответствует [Н+] = 10-4 моль/л (рН = 4). Наконец,
Таблица 20.1. Изменение рН при титровании 10,0 мл 0,1 н. раствора сильной кислоты 0,1 н. раствором сильного основания*
| Прибавлено NaOH, мл | Объем непрореагировавшей кислоты, мл | С(НСl), моль/л | C(NaOH), моль/л | [Н-], моль/л | рpН |
| 0,00 | 10,00 | 1 • 10-1 | - | 1 • 10-1 | Н1 |
| 9,00 | 1,00 | 1 • 10-2 | - | 1 • 10-2 | |
| 9,90 | 0,10 | 1 • 10-3 | 1 • 10-3 | ||
| 9,99 | 0,01 | 1 • 10-4 | - | 1 • 10-4 | |
| 10,00 | Точка эквивалентности | - | 1 • 10-7 | ||
| 10,01 | - | - | 1 • 10-4 | 1 • 10-10 | |
| 10,10 | - | - | 1 • 10-3 | 1 • 10-11 | |
| 11,00 | - | - | 1 • 10-2 | 1 • 10-12 | |
| 20,00 | - | - | 1-10-1 | 1 • 10-13 |
_____________
* В результате изменения объема раствора концентрации НСl и NaOH вблизи точки эквивалентности оказываются примерно в 2 раза меньше, чем табличные. Значение рН в этих точках в действительности выше, а рОН - ниже приблизительно на 0,3 ед. рН. Например, когда добавлено 9,00 мл щелочи и общий объем раствора составит 19,00 мл, тогда концентрация кислоты и рН раствора равные соответственно С(НСl) = 0,1 • 1/19 - 0,0053, [Н+] = 5,3 • 10-3 моль/л, рН = 2,28.
при добавлении 10,0 мл щелочи достигается точка эквивалентности и рН = 7. В результате реакции нейтрализации образуется соль хлорид натрия, не подвергающаяся гидролизу, а концентрация ионов Н+ и ОН- будет одинаковой. При дальнейшем добавлении щелочи (свыше 10 мл) рН продолжает повышаться, причем концентрация ОН- - ионов будет увеличиваться в том же порядке, как происходило уменьшение концентрации водородных ионов Н+. При избытке 0,01 мл щелочи (т.е. добавлено 10,01 мл NaOH) концентрация ее в растворе составит примерно 10-4 моль/л, что соответствует рОН 4 и рН 10. Если добавить 0,1 мл щелочи, то ее концентрация в растворе увеличится в 10 раз и станет 10-3 моль/л, а рОН = 3 и, соответственно, рН = 11. Рассуждая точно так же, можно найти положение нескольких следующих точек. Результаты титрования вплоть до 100 % - ного избытка NaOH представлены в табл. 20.1, а сама кривая показана на рис. 20.1.
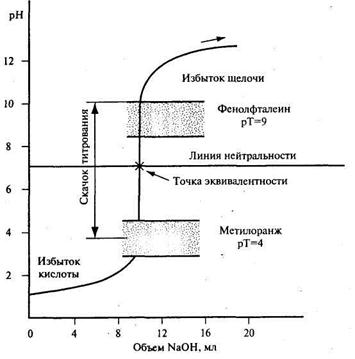
Рис. 20.1. Кривая титрования 10 мл 0,1 н. раствора сильной кислоты 0,1 н. раствором сильного основания
Из рассмотрения кривой титрования (см. рис. 20.1) видно, что вблизи точки эквивалентности наблюдается резкий скачок рН среды, составляющий 6 ед. рН, что соответствует изменению концентрации ионов водорода в 106 раз, т.е. в миллион раз. Этот скачок вызывается добавлением 0,02 мл раствора щелочи: от 9,99 до 10,01 мл. Вместе с тем прибавление в раствор кислоты почти всего требуемого объема щелочи (9,99 мл, что составляет 99,9 %) приводит к изменению рН от 1 до 4, что соответствует изменению [Н+] всего в тысячу раз.
Из данных табл. 20.1 и рис. 20.1 можно сделать следующие важные для выбора индикатора выводы.
1. При титровании сильной кислоты сильным основанием точка эквивалентности совпадает с точкой нейтральности (рН 7) и ветви кривой титрования симметричны относительно линии нейтральности.
2. Вблизи точки эквивалентности наблюдается резкий скачок рН. Его величина зависит от концентрации титруемого раствора и титранта, а также от температуры. С увеличением концентраций реагентов величина скачка рН на кривой титрования растет, а при их понижении уменьшается. Действительно, если С(НСl) = C(NaOH) = 1 моль/л, то с помощью тех же приемов расчета легко показать, что величина скачка рН на кривой титрования составит 8 ед. рН. Если же С(НСl) = C(NaOH) = 0,01 моль/л, то его величина составит 4 ед. рН. С увеличением температуры величина скачка рН на кривой титрования уменьшается, поскольку при этом увеличивается ионное произведение воды (при 298 К Кн2о = 1,0 • 10 • 14, а при 373 К Кн2о = 5,9 • 10-14).
3. Для фиксирования точки эквивалентности при кислотно-основном титровании пригоден любой индикатор, интервал перехода окраски которого лежит в пределах скачка рН на кривой титрования.
Так, для определения точки эквивалентности в рассмотренном выше случае пригоден любой кислотно-основный индикатор, интервал перехода окраски которого лежит в пределах рН 4-10. Разница в результатах титрования в случае применения метилоранжа (рТ = 4) и фенолфталеина (рТ = 9) составит не более 0,02 мл, или 0,2 %.
При титровании слабой кислоты сильным основанием (рис. 20.2) точка эквивалентности смещается с линии нейтральности в щелочную область из-за гидролиза образующейся
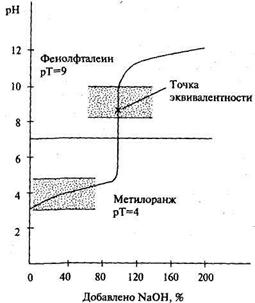
Рис. 20.2. Кривая титрования 0,1М раствора уксусной кислоты 0.1М раствором щелочи
в точке эквивалентности соли. Скачок титрования сужается и будет тем уже, чем слабее титруемая кислота. В этом случае из двух упомянутых выше индикаторов может быть использован только фенолфталеин.
При титровании слабого основания сильной кислотой (рис. 20.3) по завершении реакции образуется соль, гидролизующаяся по катиону; точка эквивалентности смещается в кислую область. Для фиксирования точки эквивалентности можно использовать метилоранж, а фенолфталеин непригоден.
При взаимодействии слабой кислоты и слабого основания изменение рН происходит постепенно на протяжении всего процесса титрования, область скачка рН на кривой титрования отсутствует, и точно определить момент эквивалентности невозможно. Поэтому растворы слабых кислот и оснований не используются в качестве титрантов при кислотно-основном титровании.
Соответственно ступенчатой ионизации многоосновных кислот их нейтрализация протекает также по ступеням.
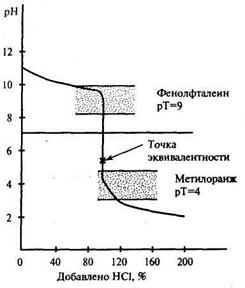
Рис. 20.3. Кривая титрования 0,1М раствора аммиака 0,1М раствором соляной кислоты
Например, при титровании раствора Н3РО4 щелочью протекают следующие реакции:
1) Н3РО4 + NaOH = NaH2PO4 + Н2О (рНт.э. = 4,66);
2) NaH2PO4 + NaOH = Na2HPO4 + Н2О (рНт.э. = 9,94);
3) NaH2PO4 + NaOH = Na3PO4 + H2O (рНт.э. ≈ 12).
Поэтому кривая титрования Н3РО4 щелочью имеет не одну, а три точки эквивалентности и только два четких скачка рН (для реакций 1) и 2)). Первая точка эквивалентности может быть определена с помощью метилоранжа или метилового красного, вторая — с помощью фенолфталеина (более точно — тимолфталеина). Из приведенных рассуждений следует, что в присутствии метилоранжа Н3РО4 титруется как кислота одноосновная, т.е. в соответствии с первым уравнением. В этом случае фактор эквивалентности ее равен 1. В отличие от этого с фенолфталеином фосфорная кислота титруется в соответствии с уравнением
Н3РО4 + 2NaOH = Na2HPO4 + 2Н2О,
т.е. ведет себя как кислота двухосновная ( fэкв =1/2). Непосредственно оттитровать Н3РО4 как кислоту трехосновную, т.е. по уравнению
Н3РО4 + 3NaOH = Na3PO4 + 3Н2О
ни с одним индикатором нельзя, так как третья константа ионизации фосфорной кислоты очень мала (К3 = 2,2 • 10-13), что приводит к исчезновению третьего скачка рН на кривой титрования.
При титровании солей слабых многоосновных кислот (например, Na2CO3, а также смесей кислот, значительно различающихся по силе (например, сильной — соляной и слабой — уксусной), на кривой титрования также фиксируется несколько точек эквивалентности.
Пригодность того или иного индикатора в каждом конкретном случае можно характеризовать индикаторной ошибкой титрования, возникающей из-за несовпадения рТ и рН в точке эквивалентности. При титровании сильной кислоты сильным основанием и наоборот ошибка может быть водородной или гидроксидной. Водородная или Н+ -ошибка возникает при рТ < 7, т.е. когда при титровании сильной кислоты щелочью в растворе после окончания титрования остается некоторое количество неоттитрованной кислоты. Для гидроксидной ошибки при титровании сильной кислоты характерно рТ > 7, что указывает на избыточное содержание в растворе сильного основания по сравнению с эквивалентным. Например, при титровании слабой уксусной кислоты рН в точке эквивалентности равно 8,9, поэтому необходимо применить индикатор с рТ = 9,0, т.е. лучше титровать в присутствии фенолфталеина. Если вместо фенолфталеина взять индикатор тимолфталеин с рТ=10,0, то этот индикатор изменит цвет при рН 10,0 и раствор будет перетитрован.
Ошибка титрования вызывается и тем, что переход индикатора из кислотной формы в основную или наоборот требует расхода реагента. В связи с этим при титровании стараются применять минимальное количество индикатора.
При увеличении температуры меняется интервал перехода окраски индикатора. Поэтому при кислотно-основном титровании все определения проводят при комнатной температуре.
Ошибки при титровании возникают также в присутствии солей и веществ, легко переходящих в коллоидное состояние, а также в присутствии некоторых органических растворителей.
Дата добавления: 2014-11-13; просмотров: 1658; Мы поможем в написании вашей работы!; Нарушение авторских прав |