
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Перманганатометрия. Характеристика метода
Метод перманганатометрии основан на реакциях окисления различных веществ перманганатом калия. Окисление проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства. Стандартный окислительный потенциал пары МnО-4 /Мn2+ составляет 1,51В, поэтому перманганат калия способен реагировать с большинством восстановителей. Продуктом восстановления КМnО4 в кислой среде является почти бесцветный ион Мn2+:
МnО-4 + 8Н+ +5ē → Мn2+ + 4Н2О,
что очень удобно для фиксирования точки эквивалентности. При титровании розовая окраска иона МnО-4 становится заметной от одной избыточной капли рабочего раствора КМnО4, поэтому никакого специального индикатора не требуется.
Для создания сильнокислой среды пользуются растворами H2SO4. Применение соляной и азотной кислот недопустимо, поскольку соляная кислота, помимо кислотных свойств, проявляет и хорошо выраженные восстановительные свойства и сама способна реагировать с КМnО4 с выделением хлора. Азотная кислота, помимо кислотных свойств, проявляет окислительные свойства и может взаимодействовать с определяемыми восстановителями.
Метод перманганатометрии широко применяют на практике для определения восстановителей и окислителей, а также веществ, не проявляющих окислительных или восстановительных свойств (например, для определения ионов Са2+ в крови). Метод также используется для контроля качества питьевой воды и определения пероксида водорода в фармацевтическом анализе.
Для определения восстановителей, как правило, используют методы прямого титрования, для определения oокислителей — методы обратного титрования, а для определения индифферентных веществ — методы как обратного, так и косвенного (заместительного) титрования.
Например, для определения пероксида водорода, ионов железа (II) и других восстановителей проводят прямое титрование их растворов стандартизированным раствором КМnО4.
Для определения окислителей, таких, как К2Сr2O7 и другие, используют метод обратного титрования, суть которого заключается в том, что к раствору окислителя добавляют заведомо избыточный и точно измеренный объем рабочего раствора восстановителя, например FeSO4. Затем остаток FeSO4, не прореагировавший с определяемым окислителем, оттитровывают рабочим раствором КМnО4. В других случаях для определения окислителей используется рабочий раствор восстановителя щавелевой кислоты Н2С2О4, которая окисляется до СО2. Таким образом, при перманганатометрическом определении окислителей необходимы два рабочих раствора.
При определении индифферентных веществ, например ионов Са2+, можно пользоваться только одним рабочим раствором КМnО4 (заместительное титрование) или двумя титрантами (КМnО4, Н2С2О4) - при обратном титровании.
При использовании заместительного титрования анализируемый раствор, содержащий ионы Са2+, обрабатывают каким-либо растворимым оксалатом, например Na2C2O4, так, чтобы все ионы Са2+ осадились в виде труднорастворимого СаС2О4. Выпавший осадок отфильтровывают, промывают и растворяют в серной кислоте:
СаС2О4 + H2SO4 = Н2С2О4 + CaSO4.
Щавелевую кислоту в полученном растворе титруют рабочим раствором КМnО4. Очевидно, что:
ν(l/5 KMnO4) = ν (l/2H2C2O4) = ν (l/2Ca2+).
На основании этого рассчитывают массу ионов Са2+ в анализируемом образце.
При использовании метода обратного титрования к анализируемому раствору, содержащему ионы Са2+, прибавляют заведомо избыточный и точно измеренный объем стандартного раствора Н2С2О4. Выпавший осадок СаС2О4 отделяют и отбрасывают, а остаток добавленной Н2С2О4 оттитровывают рабочим раствором КМnО4. В этом случае
ν (l/2Ca2+)= ν (l/2H2C2O4) - ν (l/5 KMnO4).
На основании записанного равенства рассчитывают количество или массу ионов Са2+ в анализируемой пробе.
21.3. Приготовление рабочего раствора КМnО4 и его стандартизация
Перманганат калия КМnО4 содержит примеси. Среди них имеется и соединение оксид марганца (IV) МnО2. Это соединение катализирует реакцию окисления воды перманганатом:
4 МnО-4 + 2Н2О = 4МnО2 + 3О2 + 4ОН-.
Кроме этого, при растворении в воде перманганат калия окисляет органические вещества, которые содержатся в дистиллированной воде. На устойчивость раствора КМnО4 влияет даже свет. Все эти факторы изменяют концентрацию раствора КМnО4 и вследствие этого нельзя приготовить его первичный стандартный раствор. В этом случае сначала готовят раствор КМnО4 с концентрацией, приблизительно равной требуемой (обычно 0,02 или 0,05 моль/л). Раствор оставляют на несколько дней до полного осаждения МnО2. После этого раствор КМnО4 берут для работы с помощью сифона так, чтобы осадок МnО2 остался на дне бутылки. В качестве исходных веществ для установки точной концентрации рабочего раствора КМnО4 обычно применяют оксалат аммония (NH4)2C2O4 • Н2О, оксалат натрия Na2C2O4 и щавелевую кислоту Н2С2О • 2Н2О. Наиболее удобным из этих веществ является оксалат натрия, так как он кристаллизуется без воды и не гигроскопичен. Разность окислительно-восстановительных потенциалов пар МnО-4 /Мn2+ (Е0 = 1,51В) и 2СО2/С2О42- (Е0 = -0,49В) составляет 2,01В. Большая разность потенциалов показывает, что реакция протекает практически необратимо.
Для приготовления 0,1000 н. раствора щавелевой кислоты взвешивают 1,5758 г ее кристаллогидрата Н2С2О4 • 2Н2О на аналитических весах в бюксе или на часовом стекле. Предварительно кристаллогидрат щавелевой кислоты должен быть очищен путем его перекристаллизации из воды и высушен над безводным хлоридом кальция в эксикаторе. Навеску аккуратно переносят через воронку в мерную колбу вместимостью 250 мл, после чего бюкс или часовое стекло 2-3 раза обмывают водой. Промывные воды переносят через воронку в эту же мерную колбу. Когда навеска полностью растворится, доливают раствор водой до метки, закрывают пробкой и тщательно перемешивают. Таким же образом готовится 0,1000 н. раствор оксалата натрия.
В сильнокислой среде КМnО4 количественно восстанавливается щавелевой кислотой:
2КМnО4 + 5Н2С2О4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10СО2 + 8Н2О.
Полуреакции:
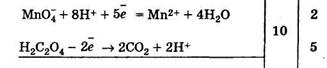
(Н2С2О4 как слабый электролит при диссоциации по второй ступени в сильнокислой среде существует в виде молекул). Хотя восстановительные свойства оксалат-ионов довольно хорошо выражены (E0(2СО2/ С2О42-) = -0,49 В), реакция между ними и МnО4 -ионами в начальный момент (первые капли КМnО4) протекает очень медленно, а последующие капли раствора КМnО4 обесцвечиваются очень быстро. Это связано с тем, что рассматриваемая реакция является автокаталитической и катализируется одним из продуктов реакции, а именно ионами Мn2+. Чтобы ускорить обесцвечивание первых порций КМnО4, реакционную смесь в колбе для титрования нагревают до 80—90 °С (кипятить нельзя во избежание разложения Н2С2О4!). После появления в реакционной смеси катализатора - иона Мn2+ - реакция становится автокаталитической и протекает с большой скоростью, так что последующие порции раствора КМnО4 в ходе титрования обесцвечиваются сразу же.
Раствор КМnО4 с установленной концентрацией, в свою очередь, может служить вторичным стандартным раствором для стандартизации раствора восстановителя FeSO4. Это титрование выполняется на холоде, так как нагревание раствора ускоряет обычную реакцию окисления ионов Fe2+ кислородом воздуха.
ВОПРОСЫ И УПРАЖНЕНИЯ
1.В какой среде применяется титрование раствором КМnО4 и почему?
2. Как фиксируется конечная точка титрования перманганатометрии ?
3. Какие методы титрования используются для определения: а) восстановителей; б) окислителей: в) индифферентных веществ?
4. Объясните, как готовится рабочий раствор КМnО4.
5.Перечислите факторы, за счет которых изменяется концентрация рабочего раствора КМnО4.
6. Какие исходные вещества применяются для установки точной концентрации рабочего раствора КМnО4?
7. Пользуясь электронно-ионным методом (методом полуреакций), составьте уравнения ОВ-реакций:
а) Н2С2О4 + KMnO4 + H2SO4 → СO2 + ... ;
б) Н2О2 + KMnO4 + H2SO4 → О2 + ... ;
в) КМnО4 + Н2О2 
г) MnSO4 + KMnO4 + Н2О → МnО2 + ... .
ЗАДАЧИ
1. Вычислите молярные массы эквивалентов: a) Fe2+; б) Na2C2O4; в) KI в реакциях с КМnО4 в кислой среде.
Ответ, а) 55,85 г/моль; б) 67,00 г/моль; в) 166,01 г/моль.
2. Сколько граммов КМnО4 надо взять для приготовления 2 л раствора с титром 0,003510 г/мл?
Ответ. 7,02 г.
3. На титрование 0,0244 г Н2С2О4 • 2Н2О израсходовано 19,5 мл раствора КМnО4. Вычислите нормальность и титр раствора КМnО4.
Ответ. 0,01986 моль/л; 0,0006276 г/мл.
4. На титрование 25,0 мл 0,0500 н. раствора КМnО4 в кислой среде пошло 10,2 мл раствора нитрита натрия. Сколько граммов
NaNO2 содержится в 100 мл его раствора?
Ответ. 0,4228 г.
5. Сколько граммов FeSO4 • 7H2O было взято для приготовления 50 мл раствора, если на титрование 25,0 мл его в кислой среде поло 20,0 мл раствора КМnО4, титр которого равен 0,000632 г/мл?
Ответ. 1,112 г.
6. К 10,0 мл анализируемого раствора К2Сr2О7 , подкисленного cсерной кислотой, добавили 20,0 мл 0,1000 н. раствора FeSO4. На итрование избытка FeSO4 пошло 28,0 мл 0,05000 н. раствора; KМnО4. Вычислите, сколько граммов К2Сr2O7 содержится в 200 мл нализируемого раствора.
Ответ. 0,5884 г.
Дата добавления: 2014-11-13; просмотров: 971; Мы поможем в написании вашей работы!; Нарушение авторских прав |