
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Йодометрия. Характеристика метода
Метод йодометрии основан на ОВ-реакциях, связанных с превращением I2 в ионы I- и обратно:
I2 + 2ē ↔ 2I- Е°(I2/2I-) = + 0,54В
окислитель восстановитель
Особенности йодометрии обусловлены в первую очередь хорошей обратимостью записанной полуреакции и невысоким значением стандартного окислительного потенциала пары I2/2I-. Значение окислительного потенциала этой пары характеризует йод как окислитель средней силы, а ионы I- - как восстановитель средней силы. Поэтому йодометрические методы применяются как для определения окислителей, так и для определения восстановителей.
Рабочими растворами в йодометрии являются стандартизированные растворы йода I2 (окислитель метода) и тиосульфата натрия Na2S2O3 (восстановитель метода). Основной титриметрической реакцией в методе является взаимодействие раствора йода и рабочего раствора тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6
Тиосульфат Тетратионат
натрия натрия
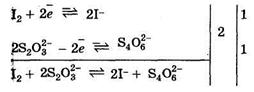
В качестве индикатора в йодометрии используется водный раствор крахмала, который образует с молекулярным йодом йодкрахмальное соединение синего цвета. При титровании восстановителей рабочим раствором йода точка эквивалентности определяется по появлению интенсивно-синего окрашивания. При титровании йода рабочим раствором тиосульфата натрия конец реакции определяется по исчезновению синей окраски от одной капли раствора тиосульфата натрия. Крахмал необходимо добавлять в самом конце титрования, когда йода в растворе становится мало и раствор приобретает соломенно-желтый цвет. Крахмал, добавленный к раствору с высокой концентрацией йода, становится черным и разрушается, что вносит ошибку в определение точки эквивалентности.
Очень высокая чувствительность крахмала к йоду и резкое изменение окраски раствора в точке эквивалентности позволяют использовать рабочие растворы меньшей концентрации, чем в других методах титриметрического анализа (от 0,01000 н. до 0,05000 н.).
Многие йодометрические реакции обратимы и протекают до конца только при создании следующих условий:
1) титрование необходимо проводить на холоде, так как, во-первых, йод - летучее соединение и, во-вторых, при нагревании чувствительность крахмала к йоду уменьшается;
2) рН раствора не должен превышать 9, так как в щелочной среде йод диспропорционирует:
I2 + 2ОН- ↔ I- + IO- + Н2О,
а IO-, являясь более сильным окислителем, чем I2, окисляет тиосульфат-ион до сульфат-иона:
S2O2-3 + 2OН- + 4 IO- = 2SO2-4 + Н2О + 4I-.
Большим преимуществом йодометрического метода является доступность чувствительного и обратимого к йоду индикатора. К недостаткам относится низкая устойчивость раствора йода и неполное протекание реакций йода со многими восстановителями.
Однако по простоте и точности метод йодометрии считается одним из лучших. В клиническом анализе им пользуются при определении сахара в крови, в медико-гигиеническом анализе - для определения «активного» хлора в хлорной извести и свободного хлора в воде. В фармацевтическом анализе метод используется для определения концентрации свободного пода, количества йодидов и тиосульфата натрия. Таким образом, метод йодометрии может использоваться для определения как окислителей, так и восстановителей. Рассмотрим подробнее их определение.
Йодометрическое определение восстановителей проводят по методу прямого или обратного титрования. Окислители определяют путем заместительного (косвенного) титрования.
При определении восстановителей методом прямого титрования рабочим раствором является раствор йода. Этим методом определяют соединения мышьяка (III), сурьмы (III), олова (II), тиосульфаты, небольшие количества H2S (например, в минеральных водах), сульфидов и сульфитов. В качестве примеров реакций, протекающих при прямом титровании восстановителей йодом, можно привести следующие:
SO2-3 + I2 + Н2O = SO2-4 + 2I- + 2Н+;
AsO2 + I2 + 2Н2О = HAsO2-4 + 2I- + 3Н+.
В тех случаях, когда прямое титрование осложнено (например, восстановитель летучий или реакция протекает очень медленно), для определения восстановителей используют метод обратного титрования. Для этого нужны два рабочих раствора — йода и тиосульфата натрия. К определяемому восстановителю добавляют точно отмеренный объем раствора йода, взятого в избытке по отношению к восстановителю. Между йодом и восстановителем происходит реакция, затем остаток непрореагировавшего йода оттитровывается раствором тиосульфата. Например, при определении H2S:
H2S + I2 = 2I- + S + 2H+;
Избыток
I2 + 2 S2O32- = 2I- + S4O2-6
Остаток
Этим методом определяют большие концентрации H2S, сульфидов, сульфитов, ряда металлов в порошках (например, цинка), некоторых органических соединений.
Для определения окислителей методом заместительного титрования поступают следующим образом. К подкисленному серной кислотой раствору KI, взятому в избытке, прибавляют точно отмеренный пипеткой Мора объем раствора определяемого окислителя (например, КСlО3) и выделившийся йод оттитровывают тиосульфатом натрия:
СlO-3 + 6I- + 6Н+ = Сl- + 3I2 + 3Н2О; I2 + 2S4O2-6
Число молей эквивалентов Na2S2O3 равно числу молей эквивалентов йода, а последнее равно числу молей эквивалентов определяемого окислителя (КСlO3). Таким образом, хотя определяемый окислитель и Na2S2O3 непосредственно друг с другом не реагируют, тем не менее их количества эквивалентны. Поэтому для вычисления можно пользоваться обычной формулой, применяемой при прямом титровании:
С(1/6КСlO3) • V(КСlO3) = C(Na2S2O3) • V(Na2S2O3).
Этим методом определяют многие окислители, например Сl2, Вr2, КМnО4, СаОСl2, нитриты, Н2О2, соли Fe(III), Cu(II), соединения мышьяка (V).
Дата добавления: 2014-11-13; просмотров: 3676; Мы поможем в написании вашей работы!; Нарушение авторских прав |