
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Броматометрия и бромометрия
Броматометрический метод основан на окислении восстановителей броматом калия в кислой среде. При восстановлении бромат переходит в бромид:
ВrО-3 + 6Н+ + 6ē → Вr- + 3Н2О.
Стандартным раствором служит 0,1 н. раствор бромата калия. Этот раствор готовят по точной навеске чистого, перекристаллизованного бромата калия и высушенного при 150 °С бромата калия. Как видно из уравнения, фактор эквивалентности (fэкв) равен 1/6, тогда его молярная масса эквивалента равна 1/6 молярной массы:
М(1/6КВrО3) = 167,00 / 6 = 27,83 г/моль.
Водные растворы бромата калия устойчивы, они не изменяют свою концентрацию в течение длительного времени (около 6 мес). Для проверки концентрации приготовленного раствора бромата калия используют метод йодометрии. С этой целью к раствору приливают раствор йодида калия и выделившийся йод титруют тиосульфатом натрия.
При титровании броматом калия первая лишняя капля бромата вступает в реакцию с образующимся в растворе бромидом. Выделяется свободный бром, который может быть обнаружен по появлению желтой окраски:
BrO-3 + 5Вr- + 6Н+ → 3Вr2 + 3Н2О.
Однако без использования индикаторов эквивалентную точку нельзя зафиксировать достаточно точно. Поэтому для определения конца титрования применяют азоиндикаторы, например метиловый красный или метиловый оранжевый. При достижении эквивалентной точки эти индикаторы окисляются выделившимся бромом и разрушаются: цвет раствора из красного переходит в бледно-желтый. Переход окраски связан с разрушением индикатора, поэтому этот процесс необратим. При быстром добавлении бромата калия окраска может исчезнуть раньше достижения точки эквивалентности. В этом случае рекомендуется к концу титрования добавлять еще несколько капель индикатора и проводить осторожное добавление окислителя.
Для увеличения скорости реакции титрование броматом проводят при нагревании раствора до 80 °С.
Броматометрию применяют для определения мышьяка (III), сурьмы (III), железа (III), пероксида водорода и др. Броматометрию используют также в анализе органических соединений. Броматом можно непосредственно титровать тиомочевину, тиоэфиры, щавелевую кислоту и другие соединения.
Бромометрия, или бромат - бромидный метод основан на окислении восстановителей свободным бромом:
Вr2 + 2ē ↔ 2Вr -.
Некоторые вещества непосредственно не реагируют с броматом, но количественно реагируют с бромом. При добавлении избытка бромида и кислоты к определенному количеству раствора бромата калия с точно известной концентрацией выделяется эквивалентное количество брома:
КВrО3 + 5КВг + 6НС1 = ЗВг2 + 6КС1 + ЗН2О.
Таким образом может быть получен раствор брома точно определенной концентрации. Выделившийся бром вступает в реакцию бромирования со многими органическими веществами, особенно с теми, которые содержат в своем составе одну или несколько фенольных групп: фенол, резорцин, тимол, салициловая кислота и др. Например, при бромировании фенола количественно образуется трибромфенол и бромоводородная кислота:
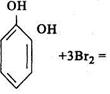

При бромометрическом определении применяют различные способы титрования: прямое, косвенное и обратное.
В случае определения фенола к анализируемому раствору добавляют бромид калия и хлороводородную кислоту и титруют 0,1000 н. раствором бромата калия в присутствии метилового оранжевого. Для определения фенола и резорцина в фармацевтическом анализе используется метод заместительного титрования. К раствору анализируемого вещества добавляется определенный объем раствора КВrО3, КВr и НСl. Смесь оставляют на 10 мин. За это время происходит реакция бромирования вещества выделившимся свободным бромом. Избыток не прореагировавшего брома определяют, добавляя к смеси раствор KI. Бром количественно вытесняет йод из KI. Выделившийся йод титруют раствором Na2S2O3.
Таким образом, при определении фенолов (например, резорцина) протекают четыре химические реакции:
1) КВrО3 + 5КВr + 6НСl = 3Вr2 + 6Сl + 3H2O
2)

3) 2KI + Вr2 = I2 + 2КВr;
4) I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Метод используется также для определения многих ионов металлов (магния, алюминия, меди, кадмия) в присутствии 8-оксихинолина.
Лабораторная работа. Определение содержания резорцина в растворе.
Цель. Приобрести навыки количественного определения резорцина в препарате методом заместительного титрования.
Оборудование. Мерная колба, колбы конические для титрования, пипетки, бюретка.
Реактивы. Резорцин, рабочие растворы бромата калия и тиосульфата натрия, раствор крахмала с его массовой долей 0,5 %, 3 н. раствор хлороводородной кислоты, бромид и йодид калия.
Выполнение эксперимента. Около 400 мг резорцина (точная навеска) растворяют в мерной колбе вместимостью 500 мл с притертой пробкой. Раствор тщательно перемешивают. С помощью пипетки Мора 20 мл полученного раствора помещают в коническую колбу с притертой пробкой вместимостью 200 мл, добавляют с помощью пипетки Мора 25 мл 0,1 н. раствора бромата калия, 1 г бромида калия и 15 мл 3 н. раствора соляной кислоты ( с помощью мерного цилиндра). Закрывают колбу пробкой, раствор перемешивают в течение 1 мин и оставляют в темном месте на 5 мин. После этого к смеси добавляют 0,5 г йодида калия, перемешивают, снова оставляют на 5 мин и титруют раствором тиосульфата натрия (0,1000 моль/л) до светло-желтой (соломенной) окраски раствора, добавляют 1 мл крахмала и продолжают титровать медленно до исчезновения синей окраски..
Параллельно проводят контрольный опыт. В коническую колбу с притертой пробкой вносят 20 мл дистиллированной воды и далее добавляют все реактивы в той же последовательности, как в основном опыте. Полученный раствор титруют также раствором тиосульфта натрия, соблюдая те же условия титрования, как в основном опыте.
Обработка результатов эксперимента. Содержание резорцина в навеске вычисляют следующим образом.
1. Рассчитывают массу добавленного бромата калия КВrО3:
m(KBrO3) = Т(КВrО3) • V(КВrО3) =
= C(l/6KBrO3) • M(l/6KBrO3) • V(KBrO3) 1000
2. Рассчитывают массу брома, выделившегося после реакции КВrО3 с КВr:
m'(Br2) = m(KBrO3) • 3M(BrO2)
М(КВrО3)
где 3М(Вr2) - три моля выделившегося молекулярного брома после реакции бромата калия с бромидом калия.
3. Рассчитывают массу непрореагировавшего брома по результатам титрования:
m"(Br2) = TNa2s2o3/Br2 • VNa2s2o3 = C(Na2S2O3) • M(1/2Br2) • VNa2s2o3 ,
где VNa2s2o3 - объем раствора тиосульфата натрия, равный разности между объемами растворов тиосульфата натрия, пошедшего на титрование в основном и контрольном опытах.
4. Рассчитывают массу брома, которая прореагирует с резорцином:
m(Br2) = m'(Br2) - m"(Br2).
5. Рассчитывают массу резорцина в 20 мл взятого раствора по уравнению, согласно которому при бромировании 1 моль резорцина взаимодействует с 3 молями брома:
m(рез.) = M(рез.) • т(Вr2)
3М(Вr2)
где М(рез.) - молярная масса резорцина, равная 110,11 г/моль.
6. Учитывая, что масса резорцина в 500 мл раствора равна массе резорцина в навеске, определяют массовую юлю резорцина в навеске:
ω% = m(рез.) • 25 •100%.
m(нав.)
Делают вывод о содержании резорцина в проанализированном препарате и о качестве препарата.
Дата добавления: 2014-11-13; просмотров: 1594; Мы поможем в написании вашей работы!; Нарушение авторских прав |