
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакции окисления
При окислении сульфаниламидов как ароматических аминов образуются окрашенные соединения. Окисление может проходить под действием кислорода воздуха, особенно в растворах. Так, быстрое пожелтение раствора сульфаци л-натрия свидетельствует о появлении окрашенных продуктов окисления. Степень окисления сульфаниламидов
(появление окрашенных соединений) регламентируется ГФ X путем определения цветности растворов. Так, в анализе чистоты сульфацил-натрия проводится определение степени окраски его раствора определенной концентрации, которая не должна превышать окраску эталона цветности № 5а.
Реакции окисления (кислород, свет, углекислый газ)
При окислении сульфаниламидов как ароматических аминов образуются окрашенные соединения. Окисление может проходить под действием кислорода воздуха, особенно в растворах. Так, быстрое пожелтение раствора сульфацил-натрия свидетельствует о появлении окрашенных продуктов окисления. Степень окисления сульфаниламидов
(появление окрашенных соединений) регламентируется ГФ X путем определения цветности растворов. Так, в анализе чистоты сульфацил-натрия проводится определение степени окраски его раствора определенной концентрации, которая не должна превышать окраску эталона цветности № 5а.
Установлено, что при этом образуются окрашенные соединения хиноидной структуры типа индофенолов. Лл< S"n*,

Реакция с растворами солей тяжелых металлов.Ряд ионов тяжелых металлов (меди, кобальта, железа, серебра и др.), замещая подвижный атом водорода сульфамидной группы, образуют с сульфаниламидами внутрикомллексные соединения. Нерастворимые комплексы меди (И) и кобальта (II) имеют различную окраску. Реакции следует выполнять в нейтральной среде, чтобы не допустить образования осадков гидроксидов указанных катионов.
Раствор сульфата меди образует с сульфаниламидом (стрептоцидом) зеленоватый с голубым оттенком осадок, с норсульфазолом грязнофиол. комплекс в отличие от стрептоцида.
2CuSO4 + 2NH2OH—--> Cu2SO4 + N2 + H2SO4 + 2Н2О

Частные реакции на сульфаниламиды.К числу таких реакций следует отнести обнаружение (по запаху) уксусной кислоты при кислотном гидролизе сульфацетамида натрия.
о

Для отличия натриевых солей от соответствующих сульфаниламидов выполняют реакцию на ион натрия (окраска бесцветного пламени горелки в желтый цвет).
Сульфацетамид натрия при действии уксусной кислотой выделяет белый осадок сульфацетамида, который после высушивания должен иметь температуру плавления около 183°С:

При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат,имеющий характерный запах:

Испытания на чистоту
В сульфаниламидах определяют отсутствие или предельное содержание допустимы? ■личеств органических примесей, сульфатов, хлоридов, сульфатной золы и тяжелы? :таллов, контролируют рН среды (кислотность или щелочность), прозрачность, цветност] створов. Гидраты (сульфацетамид натрия), подвергают проверке на потерю в массе upi юушивании. Для испытания на посторонние органические примеси используют ТСХ н; :астинках Силуфол или АрмсорбУФ-254. После хроматографирования в условиях введенных в ФС, должно просматриваться только одно пятно, соответствующе* андартному образцу свидетеля. Содержание примесей определяют по величине \ [тенсивности пятен соответствующих свидетелей, нанесенных на ту же пластинку ;танавливают также микробиологическую чистоту сульфаниламидов (ГФ XI, в. 2, с. 193).
Методы количественного определения
Нитритометрия. Этот метод рекомендован НД для количественного определения сульфаниламидов, являющихся первичными ароматическими аминами. Определение основано на способности первичных ароматических аминов образовывать в кислой среде диазосоединения:

В качестве титранта используют нитрит натрия (0,1 М раствор). Титруют в присутствии бромида калия при 18-20°С или при 0-10°С. Бромид калия катализирует процесс диазотирования, а охлаждение реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить разложение соли диазония. Точку эквивалентности можно установить одним из трех способов: с помощью внутренних индикаторов (тропеолин 00,нейтральный красный, смесь тропеолина 00 с метиленовым синим); внешних индикаторов (иодкрахмальная бумага) или потенциометрически.
Натриевые соли сульфаниламидов можно титровать кислотой в спирто-ацетоновой среде (инд. метиловый оранжевый):

Ьроматометрия. Метод основан на реакции галогенирования сульфаниламидов. 1итруют раствором бромата калия в кислой среде в присутствии бромида калия. Конечную точку устанавливают при прямом титровании по обесцвечиванию (бромом) индикатора метилового оранжевого, а при обратном титровании иодо-метрически:
КВЮ + 5КВг + 6HCI-—> ЗВг2 + 6KCI + ЗН2О

Иодхлорометрия. Как и броматометрия метод основан на реакции галогенирования. Иодирование осуществляют с помощью титрованного раствора иодмонохлорида. Избыток последнего устанавливают иодометрически:
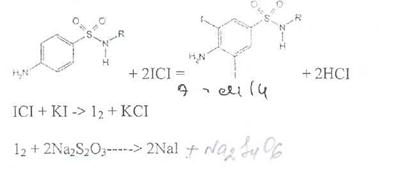
Методы ФЭКМ, основанные на цветных реакциях образования азокрасителей с использованием таких азосоставляющих, как хинозол, резорцин, ° *-^

Для идентификации и количественного определения сульфаниламидов может быть использован один из наиболее информативных методов — спектроскопия ПМР. Оптимальным для получения ПМР-спектров является 5%-ный раствор NaOD в D2O. Для всех сульфаниламидов являются характеристическими дублеты протонов бензольного цикла (п-аминобензолсульфониламидной группы) в области 6,7-8,2 м.д с суммарной интенсивностью 4 Н. В фармацевтическом анализе используют характеристические дублеты протонов бензольного цикла для алифатических (R) производных, а сигналы поглощения протонов гетероциклов и их заместителей — для сульфаниламидов, имеющих гетероциклическую и ароматическую структуру.Для обнаружения и количественного" определения сульфаниламидов, в т.ч. в биологических жидкостях, применяют метод ТСХ и метод ВЭЖХ с использованием подвижной фазы, состоящей из воды, метанола и фосфатного буферного раствора (рН 4,9),
Дата добавления: 2015-01-13; просмотров: 529; Мы поможем в написании вашей работы!; Нарушение авторских прав |