
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обеспечение химической стабильности.
Основными способами стабилизации глазных капель являются регулирование значений рН и введение в состав растворов, содержащих легкоокисляющиеся вещества, антиоксидантов. Для регулирования значения рН используются буферные растворители. Чаще всего в качестве буферного растворителя применяется борная кислота 1,9 - 2%. В качестве антиоксидантов: натрия сульфит, натрия метабисульфит и трилон Б.
В качестве вспомогательных веществ используют буферные растворы и др. стабилизаторы для повышения стабильности при хранении, натрия хлорид для обеспечения изотоничности, пролангаторыСократить частоту истилляций глазных капель и одновременно увеличить время контакта с тканями глаза можно путем пролонгирования является включение в состав глазных капель вязких растворителей, которые замедляют быстрое вымывание ЛВ из конъюктивального мешка. В качестве таких веществ раньше использовали масла (подсолнечное рафинированное, персиковое или абрикосовое). Однако более эффективными пролонгаторами для глазных капель оказались синтетические гидрофильные ВМС, такие, как МЦ (0,5% - 2%), Na - соль КМЦ (0,5 - 2%) поливинол (1,5%), микробный ПС аубазидан (0,1 - 0,3%), полиглюкин и др. Эти вещества не раздражают слизистую оболочку глаза, а также совместимы со многими ЛВ и консервантами.
В настоящее время в виде суспензий для офтальмологии применяют препараты стероидных гормонов. С целью предотвращения образования агрегатов или хлопьев, плохо смачивающихся дисперсионной средой, в. их состав рекомендуется вводить ПЭГ-400 и 0,1—0,15% раствор натрия хлорида.
Использование консервантовв производстве препаратов парентерального назначения. Одна из причин снижения качества лекарственных средств — их микробная контаминация в процессе производства или применения, которая может привести к снижению терапевтического эффекта препаратов или развитию у больного различного рода заболеваний. В связи с этим инъекционные лекарственные формы можно применять только при отсутствии в них микроорганизмов, т. е. стерильными. Введение консервантов в растворы проводится в тех случаях, когда сохранение стерильности гарантировать нельзя
Каждое антимикробное вещество, используемое для консервации лекарств, должно обеспечивать безопасность больного и необходимое качество лекарственного препарата. Исходя из этого к консервантам предъявляются следующие требования:
— широкий спектр антимикробного действия при низких концентрациях;
— хорошая растворимость;
совместимость с большинством лекарственных и вспомогательных веществ, упаковочными материалами;
- стабильность в широком интервале рН и температуры среды в течение срока годности лекарственного препарата;
— отсутствие влияния на органолептические свойства лекарственного препарата;
— отсутствие способности к образованию устойчивой формы микроорганизмов. Консерванты не должны снижать фармакологическую эффективность действующего
вещества или оказывать токсическое, аллергизирующее и раздражающее действие на организм человека.
Производство тюбик-капельницВполне обоснованно считается, что только в условиях фармацевтического предприятия могут быть созданы условия, позволяющие обеспечить весь комплекс необходимых требований, предъявляемых к глазным лекарствам на современном этапе научно-технической революции. В настоящее время преобладающее большинство глазных капель отпускается в тюбик-капельницах.
Тюбик-капельница представляет собой полиэтиленовый контейнер емкостью 1,5±0,15 мл для упаковки, транспортирования, стерильного хранения и инстилляции водных растворов лекарств для глаз. Она состоит из корпуса, свариваемого в асептических условиях после заполнения стерильным раствором, и защитного колпачка с прокалывающим устройством.
Общая технология производства тюбик-капельницы.
Технологический процесс приготовления раствора:
— растворение ингредиентов;
— подготовка помещений для фильтрации и розлива;
— подготовка аппаратов для приема раствора;
— подготовка фильтров и стерильная фильтрация.
Растворы в тюбик-капельницах готовятся в помещениях 2-го класса чистоты в условиях асептики. Помещение и аппаратура подвергаются влажной уборке, дезинфекции 3—5% раствором фенола и стерилизации бактерицидными лампами в течение 2 ч.
Растворы лекарственных веществ готовят в никелированных аппаратах из нержавеющей стали в соответствии с прописью лекарственной формы.
После проведения анализа раствор передается на стерильную фильтрацию и далее поступает в стерилизованный аппарат для последующего наполнения тюбик-капельниц.
Для получения готовой продукции используется вибрационная установка, представляющая собой герметически закрытый агрегат, внутри его поддерживается избыточное давление стерильного воздуха. В установке периодически движется непрерывная конвейерная цепь, по которой подаются отдельные детали тюбик-капельницы.
Перед сборкой тюбик-капельницы и колпачки промываются дистиллированной водой и подвергаются газовой стерилизации при 40—50 °С смесью этиленоксида и 10% углерода диоксида в течение 2 ч, после чего остатки газа удаляют выдерживанием изделий в течение 12 ч в стерильном помещении. Далее в асептических условиях в установке для сборки происходит навинчивание колпачков на корпус, наполнение его раствором лекарственного вещества и запайки термосвариванием. На печатной машине одновременно с двух сторон на корпус наносится надпись с названием лекарственного препарата, указанием его концентрации и объема.


Рис. 2. Общая схема производства тюбик-капельницы
Тюбик-капельницы подвергаются визуальному контролю на отсутствие механических включений на белом и черном фоне. Помимо оптического просмотра проводят также дополнительную выборочную проверку по всем показателям — 5% от каждой партий.
Упаковывают тюбик-капельницы в одноместные футляры, в картонные коробки или в полихлорвиниловую пленку).
Кроме этой упаковки, по ГОСТу 17768-80 для глазных капель рекомендуют стеклянные флаконы с пробкой-пипеткой из нестабилизированного полиэтилена низкой плотности Перед наполнением раствор стерилизуют фильтрованием, а пробки-пипетки — газовой стерилизацией этиленоксидом с 10% углерода диоксида.
Методы стерилизации
По требованиям Государственной фармакопеи XI издания все готовые лекарственные препараты должны выдерживать тест на микробиологическую чистоту. Поэтому процесс стерилизации имеет большое значение при изготовлении всех лекарственных форм, а особенно инъекционных.
Под стерилизацией (обеззараживание, обеспложивание) понимают совокупность физических, химических и механических способов освобождения от вегетативных и покоящихся форм микроорганизмов (Н. Horn, 1984).
ГФ XI издания определяет стерилизацию как процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития.
От правильно подобранного метода стерилизации зависит качество производимой стерильной продукции.
В технологии лекарственных форм промышленного производства в настоящее время используют 3 группы методов стерилизации:
— механические;
— химические;
— физические.
Механические методы стерилизации
Стерилизующая фильтрация. Микробные клетки и споры можно рассматривать как нерастворимые образования с очень малым (1—2 мкм) размером частиц. Подобно другим выключениям, они могут быть отделены от жидкости механическим путем —фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации включен в ГФ XI для стерилизации термолабильных растворов.
По механизму действия фильтрующие перегородки, используемые для стерильной фильтрации, подразделяют на глубинные и поверхностные (мембранные) с размером пор не более 0,3 мкм.
Глубинные фильтры характеризуются сложным механизмом задержания микроорганизмов (ситовым, адсорбционным, инерционным). Ввиду большой толщины таких фильтров удерживаются и частицы меньшего размера, чем размер пор фильтрующей перегородки.
Глубинные фильтры классифицируют на: керамические и фарфоровые (размер пор 3—^ мкм), стеклянные (около 2 мкм), бумажно-асбестовые (1—1,8 мкм). Недостатками керамических и фарфоровых фильтров является продолжительность стерилизации, потеря раствора в порах толстого фильтра, образование микротрещин из-за хрупкости материала и, следовательно, ненадежность стерилизации.
Так, стеклянные и бумажно-асбестовые фильтры несовершенны. Стеклянные фильтры малопроизводительны, бумажно-асбестовые фильтры не рекомендуются для стерилизации инъекционных растворов, поскольку они состоят из волокнистых материалов и имеется угроза отрыва волокон от фильтра. Попадая в организм с раствором, такие волокна могут вызывать различные патологические реакции.
В последние годы большое распространение для стерилизующей фильтрации получили микропористые мембранные фильтры. Они лишены недостатков, присущих стеклянным и бумажно-асбестовым фильтрам.
Мембранные фильтры представляют собой тонкие (100— 150 мкм) пластины из полимерных материалов, характеризующиеся ситовым механизмом задержания микроорганизмов и постоянным размером пор (около 0,3 мкм). Во избежание быстрого засорения фильтра мембраны используют в сочетании с префильтрами, имеющими более крупные поры. При стерилизации больших объемов растворов оптимальным является применение фильтров обоих типов.
Использование глубинных и мембранных фильтров обеспечивает необходимую чистоту, стерильность и апирогенность растворов для инъекций.
Стерилизующая фильтрация имеет преимущества по сравнению с методами термической стерилизации. Для многих растворов термолабильных веществ (апоморфина гидрохлорид, викасол. барбитал натрия и другие) его признают единственно доступным методом стерилизации. Метод весьма перспективный в производстве глазных капель.
Химические методы стерилизации
Методы основаны на высокой специфической (избирательной) чувствительности микроорганизмов к различным химическим веществам, что обусловливается физико-химической структурой их клеточной оболочки и протоплазмы. Механизм антимикробного действия многих таких веществ еще недостаточно изучен. Считают, что некоторые вещества вызывают коагуляцию протоплазмы клетки, другие — действуют как окислители. Ряд веществ влияет на осмотические свойства клетки, многие химические факторы вызывают гибель микробиологической клетки благодаря разрушению ферментной системы. Основа любого варианта химической стерилизации — взаимодействие бактерицидного вещества с компонентами микробной клетки или споры.
Химическая стерилизация подразделяется на стерилизацию растворами (веществами) и стерилизацию газами (газовая стерилизация).
Стерилизация растворами или веществами. Стерилизацию растворами (веществами) серийно выпускаемой инъекционной продукции в заводских условиях не используют, так как введение в раствор постороннего биологически активного вещества нежелательно из-за возможных химического взаимодействия стерилизующего агента с действующими компонентами и побочных действий этого агента на организм человека. Еще однопринципиальное ограничение данного метода связано с тем, что практически любое бактерицидное вещество обладает определенной селективностью и его эффективность проявляется при высоких концентрациях или часто в определенных интервалах рН. недопустимых для живых организмов. Этот вид стерилизации используют для обеззараживания различной аппаратуры, трубопроводов и другого оборудования, применяемого в производстве стерильной продукции.
Газовая стерилизация. К своеобразной химической стерилизации следует отнести метод стерилизации газами. Преимущество метода — возможность стерилизации объектов в пластмассовой упаковке, проницаемой для газов. В герметическую камеру вводят стерилизант —■ смесь этиленоксида и углерода диоксида в соотношении 9:1. Углекислый газ добавляют в связи со взрывоопасностью окиси этилена. При стерилизации стерилизант поступает в аппарат под давлением до 2 кгс/см2 (196133 Н/м2) при температуре 43—^5 °С. Продолжительность стерилизации зависит от проницаемости упаковки, толщины слоя материала и продолжается от 4 до 20 ч. Затем этиленоксид удаляют продуванием стерильным воздухом (азотом) или путем вакуумирования.
При химической стерилизации газами погибают все вегетативные формы микроорганизмов и плесневые грибы.
Для стерилизации донорского материала, растворов кровезаменителей или продуктов, полученных из крови, широко применяют е-пропиолактон.
Главный недостаток, химических методов стерилизации — необходимость освобождения простерилизованного объекта от остатков стерилизанта и продуктов возможного взаимодействия. Широкое распространение метода затруднительно из-за длительности стерилизации, высокой стоимости, возможности побочного действия химического агента на обслуживающий персонал. Тем не менее для ряда лекарственных препаратов — это единственно надежный способ стерилизации в современных условиях.
Использование консервантов. Добавление консервантов условно можно отнести к методам химической стерилизации. Введение консервантов в растворы проводится в тех случаях, когда нельзя гарантировать сохранение стерильности. При этом возможно снижение температуры стерилизации или сокращение времени ее проведения.
Механизмы воздействия консервантов на микроорганизмы очень различны и определяются их химическим строением. Как к основному результату при этом следует отнести нарушение жизненных функций клетки, в частности инактивацию белковой части клеточных ферментов. В зависимости от степени инактивации наступает либо гибель клетки. либо замедление ее жизненных функций.
Физические методы стерилизации
Тепловая (термическая) стерилизация. В настоящее время монопольное положение среди возможных методов стерилизации в фармацевтическом производстве занимает тепловая стерилизация.
В зависимости от температурного режима тепловая стерилизация подразделяется на стерилизацию:
— паром под давлением (автоклавирование);
— текучим паром;
— тиндализацию;
— воздушную.
Стерилизация паром под давлением. Автоклавирование — стерилизация растворов, устойчивых к нагреванию, паром под давлением 1,1 атм при температуре 119—121 °С. В данных условиях погибают не только вегетативные, но и споровые микроорганизмы за счет коагуляции белка клетки.
Этот традиционный способ стерилизации сегодня предпочтителен по трем причинам. Во-первых, он дает возможность стерилизации препаратов в конечной герметичной упаковке,что исключает опасность вторичной контаминации. Во-вторых, благодаря длительной практике использования он обеспечен достаточно надежной аппаратурой. И в-третьих, на сегодняшний день он наиболее экономичен.
При применении данного метода происходит комбинированное воздействие на микроорганизмы высокой температуры и влажности, при этом погибают самые стойкие споры. Коагуляция белковых веществ в этих условиях начинается при температуре 56 °С.
Стерилизацию паром под давлением проводят в стерилизаторах различной конструкции цилиндрической или квадратной формы. Стерилизаторы квадратной формы типа АП-7 (рис. 19.25), АП-18 имеют двери с двух сторон: через одну происходит загрузка нестерильной продукции; через другую — выгрузка простерилизованной. Корпус автоклава нагревается глухим паром, чтобы не было его конденсации в рабочей камере. Затем в камеру для вытеснения воздуха подается острый пар. Отсчет времени стерилизации начинается с момента достижения заданного давления по манометру. Стерилизаторы оснащены, автоматической контрольной аппаратурой, с помощью которой на контрольной ленте записывается давление и время стерилизации. Условия стерилизации продукции указаны в промышленных регламентах или другой нормативно-технической документации.

Рис. 21. Устройство парового стерилизатора АП-7:
/ — корпус; 2 —- крышка; 3 — теплоизоляция; 4 — стерилизационная камера;
5 — клапан предохранительный; б — пульт управления; 7 — полка;
8 —• подача острого пара
Стерилизацию растительных масел и жиров в заводских условиях осуществляют паром под давлением в герметически закрытых сосудах при температуре 119—-121 °С и давлении 1,0— 1,1 атм в течение 2 ч.
Автоклавированию также подвергаются установки для стерилизующего фильтрования, фильтрующие перегородки и другой вспомогательный материал, используемый в технологическом процессе производства инъекционных лекарственных форм.
Среди недостатков метода можно выделить невозможность стерилизации растворов, содержащих термолабильные вещества, опасность работы с паром под давлением, отсыревание многих материалов во время стерилизации и др.
Стерилизация текучим паром. Растворы веществ термически малоустойчивые иногда стерилизуют при 100 °С текучим паром (без примеси воздуха и избыточного давления). Насыщенный пар убивает только вегетативные формы микроорганизмов и при наличии в объекте споровых форм метод неэффективен.
Тиндализация (дробная стерилизация). Для термолабильных веществ, а также для растворов в шприц-ампулах стерилизацию иногда проводят методом тиндализации. Суть метода заключается в трехкратном нагревании растворов до 40—60 °С с перерывами в сутки, i течение которых объекты термостатируют при температуре 37±1 °С для прорастания :поровых форм в вегетативные.
Стерилизация сухим жаром (воздушная стерилизация). Стерилизация сухим жаром, [роводимая в аэростерилах или других аппаратах этого типа, также высокоэффективна. 1огибают все формы микроорганизмов за счет пирогенетического разложения белковыхвеществ. Однако высокая температура нагрева (160— 200 °С), длительное время воздействия (1—2 ч) и сухой горячий воздух оказывают повреждающее действие на стерилизуемые объекты и, следовательно, ограничивают возможности данного Способа.
Инъекционные растворы не подвергают стерилизации сухим жаром, так как из-за низкой теплопроводности воздух не обеспечивает быстрый нагрев растворов до температуры стерилизации, а длительный прогрев -— приводит к разложению большинство лекарственных веществ.
Сухим жаром стерилизуют некоторые термостойкие порошки, масла, стеклянную тару (ампулы, флаконы и необходимую посуду), вспомогательные материалы.
Лучшими считают стерилизаторы с ламинарным потоком стерильного воздуха, нагретого до требуемой температуры, что улучшает создание равномерного температурного поля и устраняет загрязнения от обогреваемых стенок камеры и из воздуха, попадаемого в момент выгрузки объекта.
Радиационная стерилизация. Лучистая энергия губительно действует на клетки живого организма, в т. ч. и на различные микроорганизмы. Принцип стерилизующего эффекта этих излучений основан на способности вызывать в живых клетках при определенных дозах поглощенной энергии такие изменения, которые неизбежно приводят их к гибели за счет нарушения метаболических процессов и коагуляции белка.
Источником ионизирующих у-излучений служат долгоживущие изотопы 60Со2?, b7Cs66 , ускорители электронов прямого действия и линейные ускорители электронов. Для бактерицидного эффекта достаточно от 15 до 25 кГр, причем верхний предел необходим для инактивации споровых форм.
В настоящее время накоплен большой опыт применения этого метода, точно установлены типичные дозы излучения, необходимые для надежной стерилизации, разработано радиационное оборудование для высокопроизводительного процесса стерилизации, решены вопросы безопасности работы установок для обслуживающего персонала.
Этот метод по экономическим показателям превосходит асептическое изготовление растворов со стерильной фильтрацией, но несколько уступает тепловой стерилизации. Однако в будущем может приблизиться к ней из-за неизбежного снижения относительной стоимости изотопов — побочных продуктов атомной энергетики.
Ультразвуковая стерилизация. Прохождение ультразвука (УЗ) в жидкой среде сопровождается чередующимися сжатиями, разрежениями и большими переменными ускорениями. В жидкости образуются разрывы, называемые кавитационными полостями. В момент сжатия эти полости захлопываются. Избыточное давление, создаваемое УЗ-волной, накладывается на постоянное гидростатическое и суммарно может составлять в пузырьках несколько атмосфер. В качестве «зародышей» кавитационных полостей могут быть пузырьки газа, пара в жидкости, твердые частицы и места неровностей твердой поверхности. Большие импульсные давления кавитаций приводят к разрушению целостности клеточной мембраны микроорганизмов, споровых образований и других частиц. Важно установить оптимальные параметры процесса стерилизации, так как высокие импульсные давления могут приводить к механическому разрушению ампул. Стерилизующая частота звука должна быть в пределах 18—22 кГц.
И хотя метод очень эффективен, он не нашел широкого применения из-за сложности аппаратурного оснащения и возможных сложных химических превращений компонентов растворов. Вопросы стабильности компонентов при УЗ-стерилизации имеют много общего с аналогичными проблемами радиационной стерилизации. Для повышения устойчивости лекарств при ультразвуковом воздействии необходимо подобрать такие условия стерилизующей обработки, которые обеспечивают снижение вводимой в систему энергии на тех частотах ультразвука, которые одновременно со стерилизацией не приводят к разложению компонентов лекарственных препаратов.Чаще метод применим при производстве эмульсий и суспензий с целью лучшего диспергирования веществ в них и одновременно получения стерильных гетерогенных систем для парентерального применения.
Стерилизация токами высокой и сверхвысокой частоты. К настоящему времени нет единой точки зрения на механизм инактивации микроорганизмов при ВЧ- и СВЧ-облучении. Существует мнение об исключительно тепловом механизме действия токов высокой частоты на биологические объекты. Принцип действия высокочастотного поля заключается в его активном воздействии на ориентацию молекул вещества. Изменение направленности поля вызывает изменение ориентации молекул и поглощение части энергии поля веществом. В результате происходит быстрый нагрев вещества во всех точках его массы. Менее широко распространены представления о том, что. помимо тепловых процессов, на гибель микроорганизмов оказывает влияние специфическое действие ВЧ- и СВЧ-излучения.
С помощью СВЧ-энергии возможно стерилизовать в расфасованном виде готовую продукцию: глазные мази, пасты в тубах, лекарственные средства в конвалютах, порошки, таблетки, пористые лиофилизированные массы, не содержащие гидрофильные жидкости. Стерилизация ампулир о ванных растворов и жидких лекарственных форм, укупоренных герметически — нежелательна, так как в замкнутой емкости возникает избыток давления паров испарившейся жидкости, взрывающий ее. В результате наступает разгерметизация в виде растрескивания стенок ампул или срыва укупорочного материала.
Метод также не нашел широкого применения из-за сложности аппаратурного оснащения и возможности неблагоприятного воздействия быстрого кратковременного нагрева инъекционного раствора.
Стерилизация ультрафиолетовым излучением. Из-за возможности образования ядовитых продуктов и возможности разложения биологически активных компонентов инъекционных растворов под действием УФ-излучения, метод не нашел применения для стерилизации препаратов для инъекций. Однако он широко используется для стерилизации порошков, воды для инъекций, вспомогательных материалов, воздушной среды производственных помещений, технологического оборудования и других объектов.
При стерилизации воздушной среды производственных помещений в качестве источников УФ-радиации используют специальные лампы БУВ (бактерицидная увиолевая), которые изготавливают в виде трубки из специального увиолевого стекла, способного пропускать УФ-лучи, с электродами из длинной вольфрамовой спирали, покрытой бария и стронция гидрокарбонатами. В трубке находится ртуть и аргон при давлении в несколько мм рт. ст. Источник УФ-лучей — разряд ртути, происходящий между электродами при подаче на них напряжения. Излучение лампы БУВ обладает большим бактерицидным действием, так как максимум излучения лампы близок к максимуму бактерицидного действия (254 нм).
Количество и мощность бактерицидных ламп подбирается так, чтобы при прямом облучении на 1 м~ объема помещения приходилось не менее 2—2,5 Вт мощности излучателя. Промышленностью выпускаются лампы БУВ-15, БУВ-30, БУВ-60 и др. (цифра обозначает мощность в ваттах), а также бактерицидные облучатели: настенный ОБН, состоящий из двух ламп БУВ-30; потолочный ОБП — из 4 ламп БУВ-30; передвижной маячного типа ОБПЕ — из 6 ламп БУВ-30. Облучатели используют только при отсутствии в помещении людей.
Для стерилизации воды применяют аппараты с погруженными и. непогруженными источниками УФ-радиации. В аппаратах первого типа источник УФ-излучения (бактерицидная увиолевая лампа, покрытая кожухом из кварцевого стекла) помещается внутри водопровода и обтекается водой. Данный способ стерилизации больших объемов воды для инъекций считается наиболее экономичным.
В аппаратах с непогруженными лампами они помещаются над поверхностью облучаемой воды. В связи с тем что обычное стекло практически непроницаемо для ультрафиолетовых лучей, водопровод в местах облучения изготавливают из кварцевого стекла, а это значительно повышает стоимость аппарата. В настоящее время разработан способ, приприменении которого имеется возможноств замены кварцевого стекла полиэтиленовым, свободно пропускающим УФ-радиацию.
Как положительный фактор 'следует отметить, что при стерилизации воды не происходит накопления пероксидных соединений и под действием УФ-излучения инактивируются некоторые пирогенные вещества, попавшие в воду.
Стерилизация ИК- и лазерным излучением. Электронная стерилизация.
Эти перспективные виды стерилизации практически не находят сегодня применения, хотя возможности для этого имеются.
Облучение инъекционных водных систем инфракрасным (ИК) излучением в областях поглощения воды (К—2,1 мкм) может быть эффективным средством ее нагрева и тем самым является, по сути, еще одним вариантом тепловой стерилизации. Наличие достаточно мощных источников ИК-излучения позволяет надеяться на возможность создания оборудования для высокопроизводительной технологии. Преимуществом этого метода перед традиционным автоклавированием может считаться возможноств отказа от небезопасного в обслуживании и нетехнологичного перегретого пара.
Принципиально возможны способы стерилизации с применением лазерного и электронного излучения, при этом можно достигнуть высокой эффективности стерилизации как путем интенсивного нагрева вследствие поглощения мощного излучения в воде, так и за счет селективного поглощения излучения макромолекулами микроорганизмов в многоквантовых процессах. Однако исчерпывающих исследований применительно к какой-либо конкретной системе, совокупность которых дала бы основание о создании хотя бы основ таких методов стерилизации, пока не проведено.
Методы контроля СТЕРИЛЬНОСТИ
Определение стерильности растворов проводится путем посева и инкубации на специальных тест-средах образцов каждой серии продукции. При обнаружении роста микроорганизмов хотя бы в одной пробирке испытание повторяют на таком же количестве сосудов. И только при отсутствии роста при повторном посеве серия считается стерильной. Определению стерильности подвергают ампулы или флаконы каждой серии, одновременно подвергавшиеся стерилизации в одном стерилизующем аппарате.
Метод мембранного фильтрования при определении стерильности рекомендован при выраженном антимикробном действии лекарственного вещества и испытании растворов в больших объемах.(более 100 мл). Отбирается 30 ампул, их делят на 3 группы по 10 штук, 20 используют для испытания на стерильность, 10 — для контроля полноты отмывания мембраны от лекарственного вещества. Для фильтрования применяют установку с мембраной диаметром 47 мм и размером пор 0,45±0,02 мкм. Фильтры стерилизуют при температуре 121±1 °С 20 мин. Если испытывают порошок, его растворяют в воде для инъекций, фильтруют через стерильную мембрану, которую промывают от раствора 3—5 порциями растворителя по 100 мл, разрезают стерильными ножницами на 2 части, одну из них помещают в колбу с тиогликолевой средой, вторую — в среду Сабуро, 7 дней инкубируют при ежедневном просмотре. Все операции проводят в асептических условиях. При отсутствии роста на двух средах делают заключение о стерильности серии.
Вопрос 3. Folia Salviae (Folia Salviae qfflcinalis) — листья шалфея {Salviae folium (Salviae qfficinalis folium) — шалфея лист)
Шалфея лекарственного (Salvia officinalis L) из сем. губоцветных — Lamiaceae (Labia-tae); используют в качестве лекарственного средства и лекарственного сырья.
Химический состав. Листья содержат 1-2,5 % эфирного масла. Масло состоит из цинеола (до 15 %), пинена, камфоры, туйона, сальвена и других терпеноидов. Листья содержатдубильные вещества, тритерпеноидные кислоты — урсоловую и олеаноловую, дитерпеноиды (карнозоли розманол), фенольные кислоты.

количественное определение.Аналитическую прооу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 2 мм.
Содержание эфирного масла определяют в 30 г измельченного сырья методом 1 или 2 (ГФ XI, вып. 1, с. 290). Время перегонки 2 ч.
Заготовка сырья, первичная обработка, сушка.Заготавливают вполне развитые листья в течение лета. Сбор производят главным образом механизированным способом, иногда вручную. Траву скащивают косилками, высушивают на токах или в сушилках, затем обмолачивают, отделяют листья от стеблей путем просеивания через решёта.
Хранение.Хранят сырье в сухих прохладных помещениях на стеллажах или подтоварниках, в защищенном от света месте, отдельно от других видов сырья. В аптеках хранят в закрытых фанерных ящиках. Срок годности 1,5 года (предельный).
Использование.Листья шалфея в аптеки поступают в фасованном виде. Листья входят в состав грудных сборов, а также применяются в форме настоя — вяжущего, противовоспалительного средства для полосканий полости рта. глотки, гортани при катарах верхних дыхательных путей.
Из листьев шалфея получают также суммарный препарат «Сальвин»,обладающий вяжущим и антимикробным действием. Шалфей лекарственный применяется в гомеопатии и используется в БАДах.
При приеме препаратов шалфея возможны следующие побочные эффекты: опухание губ, сухость во рту. Противопоказано их назначение при беременности. При сильном кашле, бронхиальной астме, гастрите с повышенной секрецией и нефрите рекомендуется применять с осторожностью.
Вопрос 4. Рецепт выписан верно. Срок действия рецепта - 2 мес. Рецепт отдается
больному с указание на обороте количества отпущенного препарата и даты отпуска и не
хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не
действителен».
Способ применения ЛС обозначается на русском или русском и национальном языках с
указанием дозы, частоты, времени приема и его длительности.
ПРИКАЗ МИНЗДРАВА РФ ОТ 04.03 2003 N 80 (С ИЗМ ОТ 30 01 2004) "ОБ
УТВЕРЖДЕНИИ ОТРАСЛЕВОГО СТАНДАРТА "ПРАВИЛА ОТПУСКА (РЕАЛИЗАЦИИ)
ЛЕКАРСТВЕННЫХ С (приказ должен быть на экзамене).
В аптечной организации в удобных для ознакомления местах торгового зала
должны быть размещены:
- копии лицензий на фармацевтическую деятельность и другие виды деятельности в соответствии с действующим законодательством Российской Федерации;
информация о телефонах и адресах органов управления здравоохранением и фармацевтической деятельностью;
- книга отзывов и предложений;
- информация о группах населения, имеющих право на бесплатное и льготное обеспечение внеочередное обслуживание, в соответствии с действующим законодательством Российской Федерации;
- информация о лице, ответственном за лекарственное обеспечение инвалидов Великой Отечественной войны и приравненных к ним категорий населения по льготам (для аптечных организаций, осуществляющих льготный отпуск лекарственных препаратов):
- информация о номерах телефонов и режиме работы справочной фармацевтической службы;
- информация о наименованиях отделов или зон отпуска соответствующих групп товаров;
- информация о сроках хранения лекарственных препаратов, изготовленных в аптеке (аптечном пункте)]
- ценники на предлагаемые безрецептурные лекарственные препараты и другие товары, разрешенные отпуску из аптечных организаций;
информация о сотрудниках аптечной организации. непосредственно обслуживающих население (таблички, бейджи и прочие с указанием ФИО и должности);
- информация о дежурном администраторе (ФИО, должность) и нахождении кнопки сигнального вызова дежурного администратора (за исключением аптечного киоска);
- при наличии пункта проката, информация о перечне предметов, выдаваемых на прокат;
- копия или выписка из Федеральногозакона "О защите прав потребителей"

|>илет 16. Вопрос]/ Суспензии — жидкая лекарственная форма, содержащая в качестве дисперсной^фазйГодно или несколько измельченных порошкообразных лекарственных веществ, распределенных в жидкой дисперсионной среде.
Различают суспензии для внутреннего, наружного и парентерального применения. Суспензии для парантерального применения вводят только внутримышечно. Они должны соответствовать статье «Инъекции», если нет других указаний в частных статьях.
Суспензии могут быть готовыми к применению, а также в виде порошков или гранул для суспензий, к которым перед применением прибавляют воду или другую подходящую жидкость; количество воды или другой жидкости должно быть указано в частных статьях.
В качестве вспомогательных используют вещества, увеличивающие вязкость дисперсионной среды, поверхностно-активные и буферные вещества, корригенты, консерванты, антиокислители, красители и другие, разрешенные к медицинскому применению. Перечень вспомогательных веществ должен быть указан в частных статьях. Не допускается изготовление суспензий, содержащих ядовитые вещества.
Отклонение в содержании действующих веществ в 1 г (мл) суспензии не должно превышать±10 %.
Перед употреблением суспензии взбалтывают в течение 1—2 мин, при этом должно наблюдаться равномерное распределение частиц твердой фазы в жидкой дисперсионной среде. Время седиментационной устойчивости суспензии или размер частиц твердой фазы должны быть указаны в частных статьях.
Маркировка. Для суспензий, полученных из порошков или гранул, должны быть указаны условия и время хранения после прибавления воды. Все виды суспензий должны иметь указание: «Перед употреблением взбалтывать».
Упаковка. С соответствующим дозирующим устройством.
Хранение. В упаковке, обеспечивающей стабильность при хранении и транспортировании и. если необходимо, в прохладном месте.
Расчеты. Количество стабилизатора при изготовлении водных суспензий рассчитывают с учетом степени гидрофобности лекарственных веществ. Так, для не резко гидрофобных веществ желатозу берут в соотношении 0,5 г на 1,0 г стабилизируемого вещества, для резко гидрофобных соотношение составляет 1 : 1. В тех же соотношениях могут быть использованы крахмал, МЦ. NaKMLJ. бентонит, из которых предварительно готовят 5%-ные гели.Особого подхода требует изготовление суспензии серы. Адсорбируясь на поверхности пузырьков воздуха, частицы серы всплывают на поверхность в виде пенистого слоя. В качестве стабилизатора суспензии серы целесообразно использовать калийное или медицинское мыло (на 1,0 г серы 0,1 —0,2 г мыла), так как оно, разрыхляя поры эпидермиса, способствует более легкому проникновению серы через кожу и увеличению ее фармакологической активности.
Мыло добавляют по указанию врача и при условии, что в прописи нет солей тяжелых и щелочноземельных металлов. Применение других стабилизаторов приводит к снижению фармакологической активности серы.
Rp.: Bismuthi subnitratis
Magnesii oxydi ana 2,0
Ag. purificatae 100 ml
M. D. S. По 1 чайной л. 3 раза в день.
В подставку отмеривают 100 мл воды дистиллированной. Висмута нитрат основной растирают в ступке, заем добавляют магния оксид, растирают осторожно, т.к. магния оксид легкопылящее вещество, затем с 2 мл жист. воды до получения однородной массы, которую в дальнейшем при помешивании пестиком постепенно разбавляют раствором (20 мл), оставляют на 3 мин. Тонкую взвесь сливают в отп. флакон, осадок измельчают и повторяют операцию до тех пор, пока весь осадок не перейдет в тонкую взвесь Метод взмучивания, как правило, используется для получения тонкой суспензии препаратов с большой плотностью и хорошо смачивающихся водой. Нерастворимый препарат вначале растирают с небольшим количеством жидкости, после чего полученную массу разбавляют 8—10-кратным количеством жидкости (дисперсионной среды) и оставляют на 1—2 мин для отделения наиболее крупных частиц. Впоследствии отстоявшуюся тонкую суспензию осторожно сливают во флакон для отпуска. Оставшийся осадок снова растирают с жидкостью, отстаивают и осторожно сливают. Эту операцию повторяют до тех пор, пока все вещество не превратится в тонкую, медленно осаждающуюся суспензию.
Взмучивание дает хорошие результаты при суспендировании в водных средах основных солей висмута, окисей цинка и магния, кальция фосфата, карбоната и глицерофосфата, каолина, натрия гидрокарбоната, железа глицерофосфата, сульфаниламидов. Кроме того, этот метод может быть применен для растирания гидрофобных лекарственных веществ в невязких жирных маслах, но он практически непригоден для приготовления суспензий на касторовом масле или глицерине. Устойчивость суспензий с гидрофильными веществами повышается при введении сахарного или фруктового сиропа, повышающего вязкость дисперсионной среды. В этом случае лекарственные вещества тщательно растираются с небольшим количеством сиропа, затем постепенно разбавляют остатком сиропа и водой. Стойкие суспензии гидрофобных веществ могут быть получены с помощью стабилизаторов, способных гидрофилизировать поверхность частиц суспензий и закреплять их в петлях структурных сеток.
Производство суспензий. Получение суспензий на крупных фармацевтических предприятиях осуществляется разными способами: интенсивным механическим перемешиванием с помощью быстроходных мешалок и РПА; размолом твердой фазы в жидкой среде на коллоидных мельницах, ультразвуковым диспергированием с использованием магнитострикционных и электрострикционных излучателей. Микрокристаллические взвеси получают также конденсационным способом, направленной кристаллизацией при смешивании растворов в определенных условиях температурного режима, характера перемешивания, значения рН среды и т. д.
Технолог, схема.
1.Твердое вещество предварительно измельчают до мелкодисперсного состояния на специальных машинах,
2. готовят концентрированную суспензию перемешиванием в смесителях,3. затем многократно диспергируют на коллоидных мельницах или на ультразвуковых и других установках. Для «сухих» суспензий, представляющих собой смесь лекарственного и вспомогательных веществ, образующих взвесь после добавления воды (в аптеке или домашних условиях), каждый ингредиент измельчают отдельно и просеивают через тонкое сито. После смешивания ингредиентов во избежание расслоения смесь вновь просеивают.
4.Полученную готовую продукцию подвергают анализу в соответствии с требованиями НТД,
5.стандартизуют и фасуют.
Для механического диспергирования применяют пропеллерные и турбинные мешалки закрытого и открытого типов. Пропеллерные мешалки создают круговое и осевое движение жидкости со скоростью 160—- 1800 об/мин и применяются для маловязких систем. В процессе перемешивания часто используют вакуум для удаления пузырьков воздуха, которые понижают устойчивость системы. Более мелко диспергированные и стойкие суспензии и эмульсии можно получить с помощью турбинной мешалки, создающей турбулентное движение жидкости. Мешалки открытого типа представляют собой турбинки с прямыми, наклонными под разными углами или криволинейными лопастями.
Мешалки закрытого типа ■— это турбинки, установленные внутри неподвижного кольца с лопастями, изогнутыми под углом 45—90°. Жидкость входит в мешалку в основании турбинки, где расположены круглые отверстия, и под действием центробежной силы выбрасывается из нее через прорези между лопастями кольца, интенсивно перемешиваясь во всем объеме реактора. Скорость вращения турбинки 1000—7000 об/мин.

Рис. 2. Устройство РИА проточного типа.
1 — приводной вал; 2 — ротор; 3 — патрубок выхода суспензии; 4 — крышка-статор; 5 -патрубок входа.В промышленной технологии суспензионных и эмульсионных препаратов широкое, распространение нашли РПА. При получении дисперсных систем РПА могут быть непосредственно погруженными в реактор с перемешиваемой средой, иногда в дополнение к имеющейся в нем мешалке. РПА погружного типа имеют ротор и статор с концентрически расположенными на них зубцами или цилиндрами с отверстиями и по форме напоминают мешалки. РПА проточного типа устанавливается вне реактора. Ротор и статор его заключены в корпус, имеющий входной и выходной патрубки. Обрабатываемая смесь поступает по осевому патрубку внутрь аппарата и под действием центробежной силы выбрасывается через выходной патрубок. Движение жидкости в аппарате осуществляется от центра к периферии. Существуют РПА, в которых движение обрабатываемой среды имеет противоположное направление, от периферии к центру, и диспергированная жидкость выходит через осевой патрубок.
В процессе работы РПА развиваются интенсивные механические воздействия на частицы дисперсной фазы,£здызывающие турбулизацию и пульсацию смеси. Для повышения эффективности диспергированияразработаны конструкции РПА с раздельной подачей компонентов обрабатываемой среды по специальным каналам в теле статора, с дополнительными рабочими элементами в виде лопастей на роторе или статоре, с диспергирующими телами (шары, бисер, кольца), свободно размещенными в полостях ротора, с роликовыми подшипниками в обоймах. Диспергирование в РПА такого типа происходит за счет соударения свободно размещенных тел с вращающимися и неподвижными элементами, а также путем раздавливания и истирания материала в местах контакта роликов с вращающимися и неподвижными обоймами. Распространены РПА с рифлеными поверхностями рабочих частей с различного рода зазорами между ними. Чем меньше зазор между вращающимися и неподвижными цилиндрами, тем выше степень дисперсности. Наиболее приемлем для получения мелко измельченных дисперсий радиальный зазор в 0,15— 0,3 мм.
Значительно повышается эффективность диспергирования в РПА с увеличением концентрации суспензии, так как измельчение происходит не только за счет РПА, но и путем интенсивного механического трения частиц дисперсной фазы друг с другом. Плученная концентрированная суспензия смешивается затем с остальной частью дисперсионной среды до получения требуемого готового продукта.

Рис.3. Устройство фрикционной коллоидной мельницы.
1__основание с коническим гнездом; 2 — отверстие дгнезде; 3— ротор;
4 — микрометрический винт. 
Рис4. Устройство коллоидной мельницы ударного типа. 1 — корпус; 2 — диск; 3—4 — пальцы.
С помощью РПА можно совмещать операции диспергирования порошкообразных веществ и эмульгирования смесей. Таким образом, использование РПА обеспечивает получение многофазных гетерогенных систем — эмульсионно-суспензионных смесей, таких как линимент стрептоцида, синтомицина и т. д.

Рис..6. Устройство виброкавитационной коллоидной мельницы. 1 — корпус; 2 — статор; 3
— ротор; 4 — канавки дна поверхности ротора и статора; 5 — штуцер для ввода суспензии; 6
— штуцер для вывода готовой продукции.
дает возможность получения высококачественной продукции, повышения лроизводительности труда, сокращения непроизводительных расходов и т. д.
Для получения суспензий применяют коллоидные мельницы, работающие по принципу истирания твердых частиц, фрикционные (рис.З), удара (рис..4) или истирания и удара j)hc..5), кавитации (рис..6).
Измельчение осуществляется в основном в жидкой среде. Рабочие поверхности мельниц ^падкие или рифленые, по форме в виде усеченного конуса — ротора, вращающегося в коническом гнезде — статоре, или в виде плоских дисков, из которых один неподвижен; или зба диска вращаются в разные стороны. На дисках укреплены пальцы или имеются <анавки.
При работе фрикционной мельницы ротор вращается со скоростью до 20 000 об/мин, диспергируемая смесь засасывается в щель между ротором и статором, размер которой регулируется микровинтом и составляет 0,025—0,05 мм. Смесь многократно прогоняется *ерез щель до получения суспензии с очень небольшим размером частиц.
В коллоидную мельницу, работающую по принципу удара^ смесь подается между вращающимся диском и корпусом с насаженными на них пальцами. При вращении диска истицы дисперсной фазы подвергаются мощному гидравлическому воздействию, юзникающему в результате бесчисленных ударов пальцев по жидкости, образуя тонкую ;успензию или эмульсию.Весьма эффективными в производстве суспензий являются устройства для ультразвукового диспергирования. При озвучивании гетерогенных жидкостей в зонах сжатия и разрежения возникает давление. Избыточное давление, создаваемое ультразвуковой волной, накладывается на постоянное гидростатическое давление и суммарно может составлять несколько атмосфер. В фазу разрежения во всем объеме жидкости, особенно у границ раздела фаз, в местах, где имеются пузырьки газа и мельчайшие твердые частицы, образуются полости, кавитационные пузырьки. При повторном сжатии кавитационные пузырьки захлопываются, развивая давление до сотен атмосфер. Образуется ударная волна высокой интенсивности, которая приводит к механическому разрушению твердых частиц и вырывает с поверхности раздела фаз небольшие объемы жидкости, распадающиеся на мелкие капельки и снова входящие в нее. В процессе озвучивания системы происходит не только диспергирование частиц, но и коагуляция, если превзойден предел интенсивности ультразвука и вследствие этого нарушена целостность защитных слоев частиц дисперсной фазы. С введением стабилизирующих веществ эффективность эмульгирующего действия ультразвука резко возрастает, повышается и степень дисперсности.
Существует определенная зависимость между интенсивностью ультразвука и типом получаемой эмульсии. При низкой интенсивности ультразвука образуется эмульсия типа масло в воде, с увеличением ее — вода в масле.
Для получения ультразвуковых волн используют различные аппараты и установки, генерирующие ультразвуковые колебания. Источниками ультразвука могут быть механические и электромеханические излучатели, последние подразделяют на электродинамические, магнитострикционные и электрострикционные.
К преобразователям механической энергии в ультразвуковую относится жидкостной свисток.
Принцип его работы заключается в подаче под давлением струи жидкости через сопло на острие закрепленной в двух точках пластинки (рис. 7). Под ударом струи жидкости пластинка колеблется и излучает два пучка ультразвука, направленных перпендикулярно к ее поверхности. При получении эмульсии жидкостной свисток помещают в сосуд с дисперсионной средой и через него под давлением в несколько атмосфер подают дисперсную фазу. Частота колебаний, возбуждаемых излучателем, составляет около 30 кГц.
К электродинамическим излучателямотносится высокочастотный ротационный аппарат, построенный по типу турбинной мешалки. Возбудимый им ультразвук имеет низкую интенсивность.
Магнитострикционные излучатели (рис..8) представляют собой вибрационные устройства, состоящие из магнитопровода (металлического стержня) с обмоткой, вмонтированного в сосуд с диспергируемой средой. Магнитопровод изготавливают из ферромагнитных металлов, различных сплавов и других материалов, способных менять линейные размеры при намагничивании.. 
Электрострикционные (пьезоэлектрические) излучатели представляют собой устройства, действие которых основано на пьезоэлектрическом эффекте, используются при получении ультразвука высокой частоты, от 100 до 500 кГц. Пьезоэлементами служат пластинки, изготовленные из кварца или других кристаллов, колеблющихся по толщине. Эти пластинки имеют прямоугольную форму, размер их не менее 10 X 15 X 1 мм . Одна из граней пластинки должна быть параллельна оптической оси кристалла, другая — одной из егс электрических осей. Для создания резонанса частот пластинка с обеих сторон снабжается металлическими обкладками. При сжатии или растяжении таких пластинок вдоль электрической оси, на их поверхности возникают противоположные электрические заряды. Это явление называется пьезоэффектом. При наложении электрического поля пластинка испытывает деформацию растяжения (при отрицательном заряде) или сжатия (при положительном заряде), т. е. в переменном электрическом поле прьезокварцевая пластинка совершает резонансные колебания (обратный пьезоэлектрический эффект). Для повышения интенсивности излучателя изменяют форму пластинки и применяют вогнутые, сферические и цилиндрические излучатели.
Схема диспергирования с помощью электрострикционного излучателя представлена на рис..9. Пьезоэлектрический элемент (1) устанавливается в масляной бане на специальном механизме (2) (масло играет роль изолирующего агента и является хорошим проводником акустической энергии). Над ним на расстоянии около 5 мм закрепляется колба с диспергируемыми веществами. К пьезоэлементу (металлическим обкладкам пластинки) подводится источник пееменного тока высокой частоты через газотронный выпрямитель и генератор, чтобы направление тока совпало с электрической осью элемента. Чередующиеся сжатия и разрежения в масле от пьезоэлемента передаются через стекло колбы в диспергируемую систему. Для предохранения от перегрева содержимого колбы вокруг нее размещают змеевик для пропускания холодной воды.

применение ультразвука дает возможность получить монодисперсные системы с размером частиц дисперсной фазы в интервале 0,1 —1,0 мкм и менее 0,1 мкм. Однородность и высокая степень дисперсности обеспечивает их более высокую биологическую доступность. Суспензии и эмульсии, полученные с помощью ультразвука, отличаются большей устойчивостью при хранении, чем полученные путем механического диспергирования. Озвученные эмульсии называются реверзибильными —- возвращенными. В случае расслаивания они легко ресуспендируются при встряхивании.
Благодаря бактерицидному действию ультразвука, полученные эмульсии и суспензии стерильны.
Стандартизация. Оценка качества ' готовой продукции проводится по содержанию действующих веществ. Регламентируется показатель значения рН среды, степень дисперсности частиц твердой фазы суспензий, скорость оседания частиц дисперсной фазы суспензий.
Вопрос 2. Bismuthi subnitras — висмута нитрат основной

Белый аморфный порошок
Висмута нитрат основной растворим в кислотах (азотной, хлороводородной). При этом происходит процесс, обратный получению его из средней соли: о~-&-с и H^nu^ 2Bi(NO3),+3H2O
Подлинность висмута нитрата основного устанавливают прокаливанием, которое чриводит к разложению с образованием желто-бурых паров (диоксид азота) и желтого остатка (оксид висмута):

При добавлении сульфида натрия к раствору висмута нитрата основного в минеральной кислоте выпадает коричнево-черный осадок (сульфид висмута):
2Bi(NO3)3 + 3Na2S -> Bi2S3i + 6NaNO3
Если взболтать около 0,1 г висмута нитрата основного с разведенной серной кислотой, а затем профильтровать, то после добавления к фильтрату 2 капель раствора иодидакалия образуется черный осадок иодида висмута, растворимый в избытке реактива с образованием желто-оранжевого раствора комплексной соли:
Bi2(SO4)3 + 6KI -> 2Bil3^ 3K2SO4
Bil3+ Kl -> KBil4
Висмута нитрат основной в соответствии с требованиями ФС проверяют на кислотность водного извлечения (после 30 мин взбалтывания и 6-ти часового настаивания 5 г лекарственного вещества с 75 мл воды) Проверяют потерю в массе при высушивании (не более 3%). микробиологическую чистоту (ГФ XL вып. 2, с. 193). Устанавливают также предельное содержание солей щелочных и щелочноземельных металлов (не более 0.5%), карбонатов, сульфатов, хлоридов, солей аммония, меди, серебра, свинца, мышьяка и теллура.
Количественное определение выполняют комплексонометрическим методом. Навеску, растворенную в нагретой азотной кислоте, титруют 0,05 М раствором трилона Б (ЭДТА Na2) в присутствии индикатора ксиленолового оранжевого или пирокатехинового фиолетового. В процессе титрования титрант связывает ионы висмута, образовавшиеся, при растворении лекарственного вещества в азотной кислоте, в комплексное соединение:
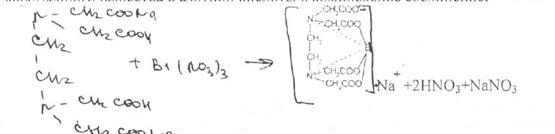
Выделяющаяся азотная кислота не мешает титрованию, так как соли висмута количественно взаимодействуют с ЭДТА Na2 при рН 2-4. Вот почему в данном случае не требуется добавления буферного раствора.
Окрашенное комплексное соединение пирокатехинового фиолетового с ионом висмута имеет меньшую константу устойчивости. чем Bi3+ с динатриевой солью этилендиаминтетрауксусной кислоты. Поэтому при титровании ЭДТАЫа2 отбирает ион висмута у индикатора и связывает его в более прочный комплекс, не имеющий окраски. В эквивалентной точке выделяется свободный индикатор, который придает раствору желтую окраску:

Учитывая непостоянство состава висмута нитрата основного, расчет содержания проводят по оксиду висмз'та, которого должно быть 79-82%.
Хранят висмута нитрат основной в хорошо укупоренной таре, предохраняющей от действия света. При доступе влаги и света он постепенно гидролизуется с образованием азотной кислоты и оксидов азота.
Висмута нитрат основной применяют как вяжущее и отчасти антисептическое средство при желудочно-кишечных заболеваниях (по 0,25-4),5 г).
Magnesium Oxyde (Magnesii oxydum) —
магния окись, магния оксид
MgO
Белый мелкий легкий порошок без запаха
Испытания на подлинность магния оксида проводят после предварительного растворения в разведенныхкислотах:
MgO + 2HCI -> MgCl2 + Н2О
Для обнаружения иона магния используют общую реакцию образования нерастворимого в воде, но растворимого в уксусной кислоте белого кристаллического осадка фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли мггния гидрофосфата динатрия и раствора аммиака:
NH4CI
МдС12 + Na2HPO4 + NH3* Н2О===- NH4MgP04i+ 2NaCI + Н2О
NH4MgPO4 + 2СН3СООН -> Mg(CH3COO)2 + NH4H2PO4
К реакционной смеси необходимо прибавлять раствор хлорида аммония (до рН 9) во избежание образования в щелочной среде аморфного осадка гидроксидамагния Mg(OH)2 (при рН > 10). Однако большой избыток хлорида аммония может препятствовать осаждению фосфата магния-аммония.
Ион магния в магния оксиде обнаруживают, осаждая его из растворов в хлороводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния представляет собой белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия. Если затем добавить несколько капель иода, то осадок приобретает темно-коричневую окраску.
В магния сульфате устанавливают наличие сульфат-иона:
MgSO4 + ВаСЬ -> BaSO4l + MgCI2Соединения магния количественно определяют прямым комплексонометрически л методом с использованием индикатора кислотного хром черного специального (эриохром черный Т). После добавления индикатора к титруемому раствору ионы магния образуют с ним непрочное комплексное соединение:


Поскольку при этом происходит выделение серной кислоты, для поддержания оптимального значения рН среды необходимо прибавлять аммиачный буферный раствор.
В эквивалентной точке, когда все ионы магния будут связаны в комплексное соединение металл — ЭДТА Na?. титрант вступает во взаимодействие с ионами магния, содержащимися в составе комплекса металл — индикатор. Последний имеет меньшую константу устойчивости, чем комплексное соединение ЭДТА Na2 — металл, поэтому происходит разрушение комплекса индикатора с ионами магния. При этом красно-фиолетовая очраска раствора переходит J3 синюю окраску свободного индикатора:

Соединения магния хранят в хорошо укупоренной таре, так"' как магния оксад взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примес! карбоната и гидроксида магния:
MgO + СО2 -> MgCO3
MgO + H2O -> Mg(OH)2
В качестве общего реактива на ион висмута и магния могут быть использованы дитизон v. 8-оксихинолин, образующие внутрикомплексные соединения оранжево-красного цвет^ Указанные реактивы используют для фотометрического определения висмута и магния. 
В данной лек. форме сумму висмута и магния определяют комплексонометрически (прямое титрование).
Объем ЭДТА, пошедший на титрование оксида меди определяют по разности:(УЭДТА, пошедший на титрование суммы - V бромата калия/2. _)
Броматометрическое определение висмута, основанное на реакции окисления металлической меди в солянокислом растворе (заместительное титрование):
BiCl4" + 3Cu + 2СГ= ЗСиСЬ"+ Bi
Полученный раствор меди (Т) титруют броматом калия в присутствии метилового оранжевого. В точке эквивалентности индикатор разрушается и раствор приобретает голубую окраску, вызванную ионами Си +.
Э=М висмута нитрата основного/2
Вопрос 3. Rhizomata Calami (Rhizomata Acori calami) — корневища аира, ирный
растения аира обыкновенного (а. болотного) — Acorus calamus L. из сем. аронниковых
(ароидных) — Агасеае; используют в качестве лекарственного средства илекарственного
сырья.
Химический состав. Корневища содержат до 5 % эфирного масла? в его составе находятся
моно- и сесквитерпеноиды: а-пинен, (+)-камфен. ( + )-камфора. борнеол. а также фенольные
соединения, например азарон. Кроме масла в корневищах содержится гликозид акорин. а
также дубильные вещества.

Камфен Пинен Борнеол Камфора Туйон
Числовые показатели. Содержание эфирного масла не менее 2 % для цельного сырья и не менее 1,5 %для измельченного сырья и порошка;
Количественное определение. Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с с отверстиями диаметром 2 мм. Содержание эфирного масла определяют в 30 г измельченного сырья методом 3 (ГФ XI. вып. с. 290). Время перегонки 1,5
Хранение. Сырье хранят в сухих прохладных помещениях на стеллажах или подтоварниках, отдельно от неароматических видов сырья. Срок годности цельного и измельченного сырья 3 года; порошка — 1 год 6 мес.
Использование. Применяют корневища в виде настоя в качестве ароматической горечи, повышающей и улучшающей пищеварение, входит в состав сбора для получения горькой настойки, порошок корневищ входит в состав комплексных препаратов «Викаир» и «Викалин», применяемых для лечения язвенной болезни и гастрита. Эфирное масло — компонент препаратов для лечения и профилактики почечнокаменной и желчнокаменной болезни. Кроме того, аир обыкновенный обладает иммуномодулирующим. антибактериальным, антипротозойным, антимикотическим, антиамебным действием. Корневища аира широко применяют в индийской, тибетской медицине и медицине европейских стран. Корневища также используют в консервной, пищеконцентратной, ликерно-водочной и парфюмерной промышленности. Растение входит в арсенал лекарственных средств гомеопатии.
Вопрос 4. Рецепт выписан верно, веществ списков А. Б, ПККН нет, дозы не проверяем. НЕО не регламентированы.
Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится б аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен».
Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности, а для Л С, взаимодействующих с пищей, времени их употребления относительно приема пищи (до, во время, после еды).
Срок хранения суспензии - 3 сут при Т невыше 25С.
НЕО регламентированы Приказом №328.
Лекарственное растительное сырье хранят в сухом, хорошо вентилируемом помещении в хорошо закрытой таре. (Содержит эфирные масла)
Резаное сырье должно находиться в тканевых мешках, порошки - в двойных мешках (многослойный бумажный — внутренний, тканевый — наружный), в картонных упаковках. Иногда допускается упаковка из полимерных материалов.
Растительное лекарственное сырье периодически контролируют согласно требованиям Государственной фармакологии.
Если сырье поражается плесенью, вредителями или теряет нормальную окраску и запах, его илибракуют, или (после переработки) используют.
\ЛлгБилет 17. Вопрос 1.)Свойства производных 5-нитрофурана Nitrofural -="нит'рофурал (Фурацилин)
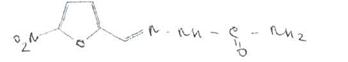
5-нитрофурфурола семикарбазон
Желтый или зеленовато-желтый мелкокристаллический порошок без запаха. Т\пл. 230-236 °С
Nitrofurantoin — нитрофурантоин (Фурадонин)

К-(5-нитро-2-фурфурилиден)-1 -аминогидантоин
Порошок желтого или желтого с зеленым оттенком цвета. Т.пл. 258-263°С (с разложением)
Furazolidone — фуразолидон

М-(5-нитро-2-фурфурилиден)-3-аминооксазолидон-2
Желтый или желтый с зеленоватым оттенком мелкокристаллический порошок без запаха. Т.пл. 253-258 °С (с разл
Дата добавления: 2015-01-13; просмотров: 364; Мы поможем в написании вашей работы!; Нарушение авторских прав |