
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 1. Объясните механизм образования ковалентной химической связи в молекуле HBr и оцените степень ее полярности.
Пример 1. Объясните механизм образования ковалентной химической связи в молекуле HBr и оцените степень ее полярности.
Р е ш е н и е. 1) Для объяснения механизма образования ковалентной химической связи необходимо определить, какие электроны участвуют в образовании этой связи. Запишем электронные конфигурации атомов и электронные схемы строения их валентных уровней; изобразим форму АО, участвующих в образовании связи.
| ↑ |
 Н 1s1
Н 1s1
Z = +1
Br 1s22s22p63s23p63d104s24p5
 Z = +35 4p
Z = +35 4p
| ↑↓ | ↑↓ | ↓ |
4s
| ↑↓ |
Для образования ковалентной связи атомы водорода и брома предоставляют по одному неспаренному электрону с антипараллельными спинами: атом Н – электрон, находящийся на s – АО (форма АО – сфера), а атом Br – электрон с
p – АО (форма АО – гантель).
2) Покажем механизм образования ковалентной связи в молекуле HBr.
В молекуле HBr связь создается за счет перекрывания двух атомных орбиталей: s – АО и p – АО с образованием между ядрами атомов H и Br зоны повышенной электронной плотности:
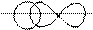 H Br
H Br
3) Для определения степени полярности связи рассчитаем разность электроотрицательностей атомов, образующих молекулу: ЭОН = 2,2; ЭОBr = 2,8; т.е. ЭОH − Br = 0,6, поэтому связь в молекуле HBr ковалентная полярная.
4) Определим вид химической связи в зависимости от способа перекрывания АО взаимодействующих атомов. В молекулах с одинарной химической связью (а именно таковой является молекула HBr) всегда образуется σ – связь как более прочная. В случае σ – связи область перекрывания АО расположена на линии, соединяющей ядра двух атомов.
Пример 2. Определите химические свойства, валентность и возможные степени окисления атома углерода в основном и возбужденном состояниях.
Р е ш е н и е. 1) Рассмотрим основное состояние атома углерода. Так как химические свойства атома определяются его электронным строением, составим электронную конфигурацию атома С и выделим строениевалентного уровня:
С Z = +6 , 1s22s22p2
2) Составим электронную схему валентного уровня и определим химические свойства атома С, его валентность и степень окисления.
| ↑ | ↑ |
| ↑↓ |
2s 2p
Валентность атома определяется числом неспаренных электронов валентного уровня. Из данной схемы видно, что атом углерода имеет два неспаренных валентных электрона, значит в основном состоянии валентность атома углерода равна двум (В=II), т.е. атом углерода может образовывать две химические связи. Вступая во взаимодействие с другими атомами, атом С стремится завершить свой внешний уровень. Поэтому он может отдать эти два неспаренных электрона, проявляя при этом восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +2: С0 − 2 ē = С+2
2s22p2 2s2 (типа He)
Но атом углерода, как неметалл, может принимать недостающие до завершения внешнего уровня четыре электрона, проявляя окислительные свойства и превращаясь в отрицательно заряженный ион со степенью окисления – 4:
С0 + 4 ē = С-4
2s22p2 2s22p6 (типа Ne)
3) Рассмотрим возбужденное состояние атома углерода. Для возбуждения атома необходимо наличие свободной АО внутри валентного уровня и спаренных электронов. Из электронной схемы строения внешнего уровня атома углерода видно, что атом С имеет вакантную АО на 2p – подуровне, а из четырех валентных электронов два электрона (2s2) спарены. Следовательно, атом углерода может находиться в возбужденном состоянии. При возбуждении происходит распаривание 2s2- электронов и переход их с 2s- на 2p – подуровень:
| ↑ | ↑ | ↑ |
С0…2s22p2 → С* … 2s12p3
| ↑ | ↑ |
| ↑↓ |
| ↑ |
2s 2p 2s 2p
Основное состояние Возбужденное состояние
При возбуждении число неспаренных электронов увеличивается до четырех. Значит в возбужденном состоянии атом углерода проявляет валентность В=IV и образует четыре химические связи. В возбужденном состоянии атом С может только отдать на связь свои 4ē, проявляя восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +4:
С0 – 4 ē = С+4
2s22p2 1s2 (типа He)
Пример 3. Определите, какая связь C−N или C−H является более полярной. Укажите, к ядру какого атома происходит смещение общей электронной пары.
Р е ш е н и е. Для определения полярности связи необходимо найти разность электроотрицательностей атомов (∆ЭО), образующих эти связи. Из табл.1 выписываем значения ЭО этих атомов и находим ∆ЭО:
ЭОС =2,5; ЭОN = 3,0; ЭОH = 2,1; ∆ЭОC−N =3,0 – 2,5 = 0,5; ∆ЭОC−H = 2,5 – 2,1 = 0,4.
Известно, что чем больше ∆ЭО атомов, образующих связь, тем выше полярность связи. Поэтому более полярной является связь C–N. При образовании ковалентной связи общая электронная пара смещается к ядру атома с большей ЭО. В химической связи C−N общая электронная пара смещена к атому N, а в химической связи C−H – к атому С.
Дата добавления: 2015-01-29; просмотров: 369; Мы поможем в написании вашей работы!; Нарушение авторских прав |