
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Закон Генри
Равновесный состав фаз в системах газ-жидкость характеризуется равновесным распределением растворимого газа между инертным газом и растворяющей жидкостью и определяется для идеальных газов по закону Генри.
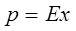 ,
,
где: р– парциальное давление газа над раствором; х – молярная доля газа в растворе; Е – константа Генри (имеет размерность давления). Закон Генри формулируется следующим образом:
Парциальное давление растворенного идеального газа пропорционально его молярной доле в растворе, или
растворимость идеального газа в жидкости при данной t-ре пропорциональна его парциальному давлению над раствором.

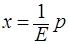 (*)
(*)
Если у* - молярное равновесное содержание растворимого газа в газовой смеси и Р – общее давление газа, то парциальное давление р будет равно:
 , подставим в (*), получим
, подставим в (*), получим
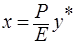 , откуда
, откуда 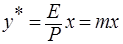 ,
,
где m – коэффициент распределения или константа фазового равновесия (безразмерная величина).
Фазовое равновесие между раствором идеального газа в жидкости и газовой смесью над ней подчиняется закону Генри только при t > t критических (для газа).
Поскольку при сильном разбавлении любой раствор приближается к идеальным, то закон Генри применим и к разбавленным растворам, при этом он работает тем точнее, чем выше разбавление.
По этой же причине закон Генри достаточно точно описывает равновесие для плохо растворимых газов.
Для газов со сравнительно высокой растворимостью закон Генри справедлив лишь при низких концентрациях; при высоких концентрациях растворимость ниже, чем это следует из закона Генри.
Закон Рауля. При температурах газа ниже критической система будет двухфазной: жидкость – насыщенный пар.
Равновесие в этом случае характеризуется составом жидкости х и составом находящегося в равновесии с жидкостью пара у*.
Равновесие фаз для жидких идеальных растворов описывается законом Рауля: – парциальное давление любого компонента в парах над смесью жидкостей равно упругости насыщенного пара этого компонента (при данной температуре) умноженной на его молярную долю в жидкости.
 ,
,
pa– парциальное давление пара компонента а над смесью жидкостей;
Рa – давление насыщенного пара компонента а при t - ре смеси,
х – молярная доля компонента а в жидкой смеси.
Для любого компонента его парциальное давление можно определить:
 и следовательно равновесный состав пара над жидкостью:
и следовательно равновесный состав пара над жидкостью:
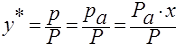 ;
; 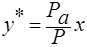
Р – общее давление паров над жидкой смесью.
Дата добавления: 2015-01-29; просмотров: 324; Мы поможем в написании вашей работы!; Нарушение авторских прав |