
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фазовое равновесие бинарных смесей
Если имеем систему, состоящую из 2-х компонентов (К=2), двухфазную (Ф = 2), то С = К +2 – Ф = 2 +2 - 2 = 2 – число степеней свободы. Систему полностью определяют три параметра: t, Р, концентрация. Согласно правилу фаз два параметра можно выбирать произвольно, а третий определяется однозначно, не может быть произвольным. Поэтому для бинарной системы жидкость – пар используют следующие фазовые диаграммы:
1) Р = f(x) при t = const;
2) t = f(x, y) при P = const
3) y = f(x) при P = const, t = const.
( у – состав паровой, x – состав жидкой фазы)
Вид этих зависимостей определяется взаимной растворимостью компонентов жидкой смеси и другими свойствами. Различаются смеси с неограниченной растворимостью; взаимно нерастворимые; ограниченно растворимые.

Рассмотрим идеальные смеси. Идеальная смесь подчиняется закону Рауля  и закону Дальтона
и закону Дальтона 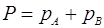 .
.
рА– парциальное давление компонента А; РА– давление насыщенного пара компонента А при данной температуре; хА – мольная доля компонента А в смеси, Р – общее давление пара над раствором, рА, рВ – парциальные давления компонентов.
Диаграмма t = f(x,y) при P = const
Смеси различного состава имеют свои температуры кипения. Откладываем tкип в зависимости от хА, получаем линию кипения; tA и tB – температуры кипения чистых компонентов. Затем определяют равновесные составы пара у1*, у2*, у3*….. по формуле уА* = РА*хА /Р. Откладывают их на оси абсцисс и проводят прямые до пересечения с изотермами t и получают точки В1, В2, соединив которые кривой АВ1В2В получают линию конденсации.
С помощью данной диаграммы удобно определять состав равновесного пара.


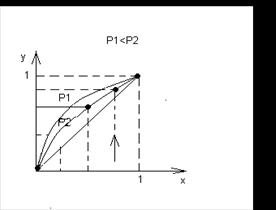
Фазовая диаграмма y = f(x) (см. нижний рисунок) при P = const представляет собой зависимость между равновесными составами жидкой и паровой фазы. Процесс дистилляции и ректификации обычно осуществляется при Р = const и диаграмма строится при различных температурах кипения, которые зависят от состава жидкой смеси: x, y,* t. С увеличением Р кривая становится менее выпуклой.
Для идеальных растворов уравнение линии равновесия можно получить аналитически на основе законов Рауля и Дальтона.
В действительности идеальных растворов не существует, но многие приближаются к идеальным (бензол – толуол).
Закон Коновалова – определяет взаимное расположение кривых на t–x–y диаграмме – пар обогащается тем компонентом, добавление которого к жидкости повышает давление паров над жидкостью или понижает её температуру кипения.
Реальные (неидеальные) смеси не подчиняются закону Рауля. Отклонение от закона обусловлено изменением активности молекул вследствие их взаимодействия. Степень отклонения характеризуется коэффициентом активности γ. У ряда смесей отклонения приводят к качественно новым свойствам смеси. Диаграммы для реальных смесей строят на основе опытных данных. Азеотропы (нераздельные кипящие смеси) удаётся разделить путём изменения давления при перегонке.
Дата добавления: 2015-01-29; просмотров: 280; Мы поможем в написании вашей работы!; Нарушение авторских прав |