
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Растворимость газов в жидкостях
Она зависит от давления и температуры. Растворимость газов неодинакова из-за различной химической природы.
Пример:
N2, H2 – мало растворимы в воде, растворимость NH3, HCl очень велика, в одном объеме H2O растворяется 700 объемов аммиака NH3.
Газ + H2O > 3,5 объема О2 в одном объеме Н2О экзотермический процесс. С повышением температуры растворимость некоторых газов уменьшается. При постоянной температуре и невысоком давлении растворимость газов, не вступающих в химическое взаимодействие с растворителем, подчиняется закону Генри – Дальтона, который состоит из нескольких частей.
1 часть: масса газа, растворяющаяся в данном объеме жидкости, пропорциональна давлению, которое газ производит на жидкость.
Например, CO2 под давлением загоняем в бутылку.
2 часть: объем газа не зависит от давления.
3 часть: если смесь газов растворять, то растворимость каждой составной части пропорциональна своему парциальному давлению.
Газы, реагирующие с водой, не подчиняются закону Генри – Дальтона.
Растворение газов в жидкостях почти всегда сопроождается выделением теплоты. Поэтому растворимость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономерность часто используют для удаления растворенных га–зов из воды (например С02 ) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некоторых органических растворителях). В этом случае повышение температуры увеличивает растворимость газа. Газ не растворяется в жидкости беспредельно. При не–которой концентрации газа X устанавливается равновесие:
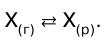
62.Учёт неидеальности растворов в кинетических исследованиях.
Поскольку константа скорости элементарной стадии включает коэффициенты активности реагентов и переходного состояния (активированного комплекса), а константы равновесия комплексов, входящих в материальный баланс по катализатору, – коэффициенты активности участников соответствующего равновесия, важно сохранить при варьировании состава раствора все γi постоянными или учитывать их изменение. Так, например, в случае механизма (16)
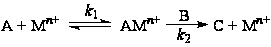 (16)
(16)
с лимитирующей второй стадией
 (17)
(17)
где 
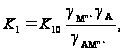 k20 и K10 – константы скорости и равновесия, не зависящие от состава раствора и определяемые природой растворителя.
k20 и K10 – константы скорости и равновесия, не зависящие от состава раствора и определяемые природой растворителя.
Естественно, при определении вида уравнения в ходе однофакторного или многофакторного эксперимента необходимо, чтобы значения k2 и K1 не менялись при варьировании [A], [B] и [  ], т.е. надо сохранить постоянными факторы
], т.е. надо сохранить постоянными факторы
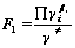 и
и 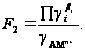
В водных растворах электролитов используют принцип постоянства ионной силы I или ионной среды (и.с.). Величина I определяется уравнением 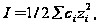 где ci и zi – концентрация иона и его заряд. Коэффициенты активности заряженных частиц согласно теории Дебая-Гюккеля зависят от I:
где ci и zi – концентрация иона и его заряд. Коэффициенты активности заряженных частиц согласно теории Дебая-Гюккеля зависят от I:
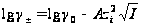 первое приближение (18)
первое приближение (18)
 третье приближение (19)
третье приближение (19)
Поддерживая в ходе эксперимента высокую и постоянную величину I (или и.с.) с помощью добавок электролитов (и.с. – концентрация инертного сильного электролита), сохраняют постоянство всех γi (F1 и F2).
Например, при исследовании кинетики окисления С2Н4 в растворах комплексов PdCl42– в присутствии ионов Cl– и H3O+ поддерживали постоянной сумму концентраций электролитов при концентрации PdCl42– ≤ 0.2 M.
Изменение коэффициентов активности сильных кислот в большом интервале концентрации кислот описываются эмпирическим уравнением (20)
 (20)
(20)
где mS – моляльная концентрация кислоты или сильного электролита.
Таким же уравнением описывается (в определённом интервале концентраций) и коэффициент активности молекул неэлектролитов. Так, например, известное уравнение Сеченова определяет растворимость органических молекул и различных газов в водных растворах электролитов
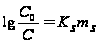 , (21)
, (21)
где С0 – растворимость в чистой воде. Это эмпирическое уравнение отражает влияние электролита не только на γ растворённой молекулы, но и на активность воды.
для термодинамической константы равновесия в растворе соли получим
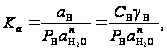 (23)
(23)
для чистой воды
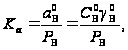 (24)
(24)
Из (24) и (23) для РВ = 1 атм. запишем уравнение для растворимости газа В
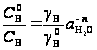 (25)
(25)
Дата добавления: 2015-01-29; просмотров: 450; Мы поможем в написании вашей работы!; Нарушение авторских прав |