
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равновесие пар-жидкость
Имеется немало примеров того, что параметры фазового равновесия жидкость — пар для смесей играют важную роль при расчетах теплообмена. В то время как точка кипения для чистых компонентов при данном давлении фиксирована, для смеси такая ситуация не сохраняется. Диапазон температур, в котором имеет место кипение (или конденсация) при заданном давлении, зависит от состава смеси.
На рис. 3 представлена диаграмма температура — давление типичной смеси легких углеводородов. Состав системы в целом, фазовое равновесие которой представлено на рис. 3, является постоянным. Составы паровой и жидкой фаз будут меняться от точки к точке. При анализе рис. 3 сразу видно различие в свойствах смеси и чистого вещества. Критическая температура чистого компонента определяется как температура, выше которой в веществе исчезает различие между жидкостью и паром. Очевидно, что такое определение неприменимо к исследуемой смеси. Здесь существует диапазон температур выше критической температуры, в котором жидкость некоторого состава может существовать одновременно и в равновесии с паром. Для чистого компонента критическое давление представляет собой максимальное давление, которое может быть создано паром. Максимальное давление на двухфазной диаграмме рис.3 превышает критическое давление, причем превышение зависит от формы кривой.

55. Законы Рауля— общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом. 
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

На поверхности оказывается меньше способных испаряться молекул растворителя, ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишьэнтропийным фактором.
Второй закон
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
. Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
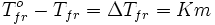
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
. Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора

Дата добавления: 2015-01-29; просмотров: 385; Мы поможем в написании вашей работы!; Нарушение авторских прав |